重组Canstatin蛋白联合氟尿嘧啶治疗裸鼠结肠癌移植瘤的实验研究
作者:马艳 王力 焦东晓 王淑芬
【摘要】 目的 探讨血管生成抑制剂Canstatin与细胞毒药物氟尿嘧啶(5-FU)联合应用结肠癌的效果,以期探索结肠癌治疗新途径。方法 结肠癌SW-480细胞(1×107/只)注射到30只裸鼠皮下,建立结肠癌皮下移植瘤模型。当肿瘤长至2~3 mm时,随机分6组。给药途径均为腹腔注射给药。治疗期间,定期用圆规和游标卡尺测量皮下移植瘤大小。 疗程结束时,取下瘤体,常规病理切片,观察药物毒性反应,CD31免疫组化染色,检测肿瘤内微血管密度(MVD)。结果 ①各试验组肿瘤的生长明显受到抑制,瘤体质量明显低于对照组(P<0.01)。5-FU+Canstatin组低、高浓度联合治疗组抑瘤作用较对照组明显增强(P<0.05),其瘤重抑制率分别为74.76%和82.04%。②免疫组化:5-FU +Canstatin组低浓度组(22.6±3.6)和5-FU +Canstatin组高浓度组(15.0±2.8)治疗小鼠肿瘤组织内MVD显著低于对照组(36.4±5.6)和5-FU治疗组(31.2±4.0)(P<0.05),而5-FU治疗组与对照组间差异无统计学意义;③不良反应:各实验组未观察到明显毒性反应。结论 重组人Canstatin蛋白能有效抑制人结肠癌生长,无明显毒副作用,为结肠癌治疗提供了新的有力的治疗方法。?【关键词】结肠癌;血管生成;血管生成抑制剂;Canstatin蛋白
?
【Abstract】 Objective To study the anti-tumor effects of recombinant canstatin protein plus 5-fluorouracil(5-FU)on colon cancer in order to develop a new treatment modality.Methods Tumor xenografts were established by subcutaneous inoculation of 1×107 SW-480 colon cancer cells into the right flanks of 30 nude mice.When the tumors reached 2~3 mm in diameter,mice were randomly divided into 6 groups.All the agents were injected intraperitoneally.During the treatment,the subcutaneous tumors were measured by compasses and caliper every 3 or 4 days.At the end of the experiment,all the tumors were resected and both routine pathological and immunohistochemical staining examinations were performed to observe the drug toxicity and intratumoral microvescular density(MVD).Results ①In every treatment group tumor growth was suppressed significantly.Intraperitoneal injection of canstatin low-dose group,canstatin high-dose group,5-FU group,5-FU group+ low-dose canstatin group,5-FU group+ high-dose canstatin group resulted in a significant inhibition of the growth of SW-480 in vivo compare with that of control group(P<0.05).The anti-tumor effect of canstatin plus 5-FU was significantly suppressed the tumor growth.At the end of the experiment,the size of tumors in combination group was the lowest(P<0.05),with the highest tumor suppression rate of 74.76% and 82.04%.② The immunohistochemical examination showed that the MVD5-FU group +canstatin low-dose group(22.6±3.6)、5-FU group +canstatin high-dose group(15.0±2.8)was significantly lower than that in NS group(36.4±5.6)or 5-FU group(31.2±4.0)(P<0.05).No significant difference was found in MVD between 5-FU and control groups.③During treatment,no obvious toxicity was observed.Conclusion Recombinant human canstatin protein effectively retards the growth of colon cancer through inhibiting the angiogenesis of tumors,without remarkable adverse effects.Synergic anti-tumor effect is achieved as canstatin is combined with cytotoxic drugs.?
【Key words】Colon cancer;Angiogenesis;Angiogenesis inhibitors;Canstatin protein
?
结肠癌是一种严重危害人类健康的恶性肿瘤,全球流行病学调查结果显示,大肠癌的发病率居肺癌、乳腺癌之后占第三位,近年各地资料显示其发病率呈逐年上升趋势,严重威胁着人们的健康与生命[1,2]。随着分子生物学的,利用DNA重组和基因转移技术的结肠癌基因治疗成为极有发展前景的治疗方法。在迄今发现的的多种抗肿瘤药物中,血管生成抑制剂以其显著的抗肿瘤效果吸引了众多的研究,Canstatin是继血管抑素和内皮抑素后新发现的一种内源性血管生成抑制剂[3-6]。 体内外实验表明,Canstatin具有抑制新生血管生成,抑制异种移植人前列腺癌和人肾癌的生长的作用,疗效甚至强于内皮抑素,引起人们普遍关注。但是,Canstatin对人结肠癌的作用如何,尚未见报道,其与传统化疗药物联合应用的疗效亦有待阐明。笔者在既往研究中,成功克隆了Canstatin基因[7],并表达出活性重组人Canstatin蛋白,在此基础上,笔者探讨了Canstatin蛋白联合化疗药物5-FU治疗结肠癌的疗效,旨在探索结肠癌治疗新途径。?
1 材料和方法?
1.1 试验动物、细胞株、药品及试剂 SPF级BALB/c裸鼠30只,4周龄,体质量16~18 g,购自药品生物制品检定所(合格证:京质字0052997)。SW-480结肠癌细胞系购于美国ATCC公司,南京凯基公司提供,单层贴壁生长,集落形成率为40%,裸鼠致瘤性为100%。5-FU购自江苏南通精华制药有限公司,CD31抗体购自北京中杉金桥生物公司。?
1.2 动物模型的建立 将已培养好基本长满瓶壁的SW-480结肠癌细胞弃培养瓶内培养基,用平衡盐溶液(PBS)冲洗培养瓶2次,加入体积分数为0.25的胰蛋白酶数滴消化,将消化好的细胞吸入离心管内,600 转/min的离心机离心6 min,弃上清,加入不含小牛血清的RPMI-1640培养基3 ml,吸管吹打混匀(取适量计数细胞)再离心,弃上清,按每只裸鼠皮下接种细胞数2.5×10??19?/L,再加入无血清RPMI-1640培养基,供裸鼠皮下接种用。准备好的SW-480细胞悬液经台盼蓝染色活细胞数占0.95以上,按每只0.2 ml SW-480细胞悬液注射于消毒后的裸鼠皮下,观察肿瘤移植成功率。?
1.3 试验分组 30只小鼠皮下移植处均成瘤,接种4 d后随机分成6组(每组5只)。①对照组(生理盐水0.3 ml/kg);②Canstatin低剂量组(1 mg/kg,用药3周);③Canstatin高剂量组(10 mg/kg,用药3周);④5-FU组(5-FU 12.5 mg/kg,用药5 d);⑤联合5-FU+Canstatin低浓度组(5-FU 12.5 mg/kg,用药5 d加Canstatin 1 mg/kg,用药3周);⑥联合5-FU+Canstatin高浓度治疗组(5-FU 12.5 mg/kg,用药5 d加Canstatin 10 mg/kg,用药3周),以上组别均采用隔天腹腔注射给药,疗程3周。
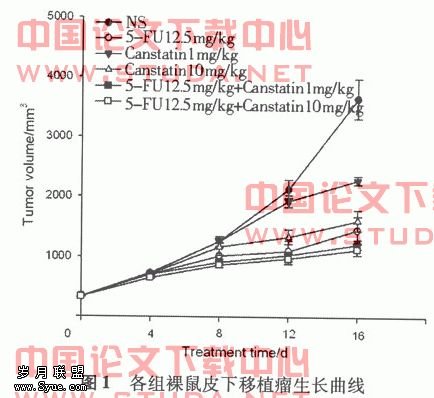
1.4 观察指标和方法 用圆规和游标卡尺测量皮下移植瘤长短经。按通用公式[V(mm3)=长×宽?2×0.52]肿瘤体积V。计算瘤重抑制率,瘤重抑制率/%=[1-(试验组平均瘤重/对照组平均瘤重)] ×100%。合并用药效果根据[8]提供的金氏公式求出q值进行判断。q=Ea+b/(Ea+Eb-Ea×Eb),Ea+b为两药合用的抑制率,Ea和Eb为各药单用的抑制率,若q<0.85说明二药合用有拮抗作用,若0.85
1.5 光镜观察及免疫组化 无菌条件下取出肿瘤组织,称重,以40 g/L甲醛固定。 为观察药物毒性反应,同时取出实验动物的心、肝、胃、胰腺、肠等组织以40 g/L甲醛固定。免疫组化染色采用链霉素抗生物素蛋白-过氧化酶法。镜下微血管计数分级方法参照Wender等[9]的方法,先在低倍光镜下(40倍)确定肿瘤内新生血管最密集区作为“热点”,进行血管计数,然后在高倍镜视野(200倍)计数5个视野,每个视野的血管平均数为该切片的MVD值。?
1.6 统计学方法 计数资料数据采用均数±标准差(x±s)表示,采用SPSS 13.0软件,单向方差分析(One-way ANOVA)进行样本均数间多重比较,两两比较用非配对t检验。?
2 结果?
2.1 裸鼠体内成瘤情况 自接种后第5天,所有裸鼠均可见接种部位小结节,约5 mm×5 mm大小,随后结节逐渐增大,至第10天,约7 mm× 7 mm。42只裸鼠全部成瘤,成瘤率达100%。?
2.2 各组药物对裸鼠皮下移植瘤生长的影响 试验结束后,各用药组瘤质量及瘤体积明显低于对照组(P<0.01),联合5-FU+Canstatin低浓度治疗组和联合5-FU+Canstatin高浓度治疗组移瘤作用进一步增强,抑瘤率分别为74.76%,82.04%,结果见图1,表1。?
2.3 各组药物对裸小鼠毒性的影响 用药期间,各治疗组小鼠均未逐渐出现精神不振、食欲下降、消瘦等表现,未见明显不良反应。疗程结束时,Canstatin治疗组和5-FU治疗组与对照组相比较,小鼠体质量差异无统计学意义(P>0.05),联合治疗组小鼠体质量高于对照组,差异有统计学意义(P<0.05)。各实验组动物心、肝、胃、胰腺、肠等脏器常规病理检查未发现明显异常。?
2.4 移植瘤组织的病理形态学观察 试验结束后,进行移植瘤组织病切片,光镜下均可见癌组织,癌细胞圆形或椭圆形,核大,核仁明显,病理分裂核多见,癌细胞被纤维组织分割成大小不等的癌巢,其间可见腺管、腺腔样结构。?
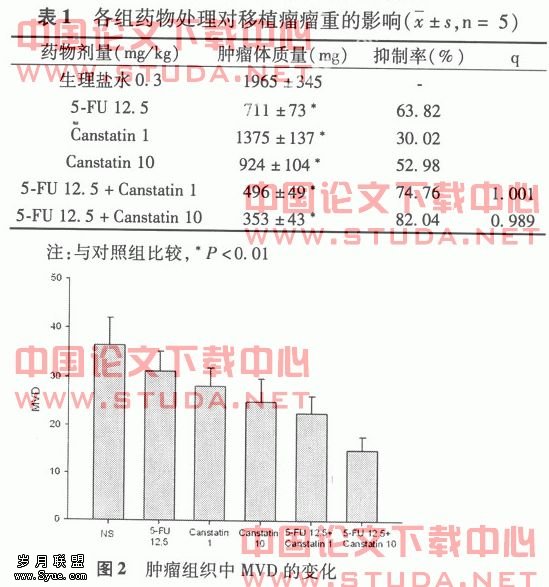
2.5 免疫组化改变 疗程结束时,病理切片经免疫组化染色,以5个高倍视野计算,各试验组MDV分别是:A组36.4±5.6; B组 31.2±4.0;C组28.2±3.7; D组25.0±4.8;;E组 22.6±3.6;F15.0±2.8 。见图2。?
3 讨论?
长期以来,对于结肠癌的治疗的实验研究,以往主要集中在对肿瘤细胞本身的抑制或杀灭作用的研究,但由于肿瘤细胞的异质性、遗传不稳定性和易产生耐药的特点,目前为止,尚未取得满意效果。自1971年,Folkman[10]首次提出,肿瘤生长依赖于新生血管形成,而后大量研究证实:肿瘤生长经历两个阶段:血管前期和血管期,在肿瘤血管前期,肿瘤细胞主要依赖弥散作用获取营养,当肿瘤生长至1~2 mm3、细胞数达到107左右时,其继续生长就必须要由新生血管来提供足够的氧气及营养物质[11]。同时,肿瘤细胞还可通过新生血管向周围组织浸润和远处转移,在继发部位形成转移灶,而转移灶的继续生长和转移仍然需要新生血管[12]。因此针对肿瘤血管的“抗血管生成疗法”近年被广泛应用于这一领域的研究,天然多肽类血管生成抑制剂以其高效、低毒、不易产生耐药等特点成为研究热点。?
Canstatin是新近发现的一种内源性血管生成抑制剂,其蛋白的相对分子量约为24 KD,它是Ⅳ型胶原α2 链NC1 区的功能域,最新研究表明:Canstatin作为胶原来源的内源性血管生成抑制因子,可剂量依赖性抑制内皮细胞管结构形成,有效抑制内皮细胞增殖和转移,且能诱导内皮细胞凋亡。其抑制肿瘤生长的效力可能超过内皮抑素[13]。李玉英等其在体外抑制血管内皮细胞增生的半数有效剂量(ED50)是内皮革抑素的1/3[14],显示了其强大的抗血管生成作用。?
本研究表明,Canstatin 10 mg/(kg•d),腹腔注射,治疗第10天起,肿瘤体积显著低于对照组,第21天时,抑瘤率达52.98%。 而治疗期间,整个治疗用药过程中小鼠活动良好,未见脱毛、腹泻等明显毒副作用。而随着Canstatin蛋白浓度的增加,抑瘤率明显增加,由30.02%到52.98%。 Canstatin治疗组小鼠体质量与对照组相比差异无统计学意义。 免疫组化结果显示,Canstatin治疗组高浓度组小鼠肿瘤内MVD显著低于对照组(P<0.05); Canstatin低浓度组与对照组差异无统计学意义,考虑可能与剂量相关;联合5-FU+Canstatin低浓度治疗组、联合5-FU+Canstatin高浓度治疗组与对照组浓度组小鼠肿瘤内MVD显著低于对照组(P<0.05),提示Canstatin抗肿瘤作用是通过与抑制肿瘤新生血管生成有关。?
化疗药对肿瘤细胞本身具有杀伤作用,而血管生成抑制剂通过抑制肿瘤新生血管形成,切断肿瘤继续生长的营养来源产生抗瘤效应。 而且参照Folkman对肿瘤抗血管生成提出的 “诱导休眠”理论,抗血管生成治疗使肿瘤体积缩小到一定程度,当肿瘤生长不再依赖新生血管时,肿瘤便蛰伏起来。但若和细胞毒药物联合使用,则有可能彻底杀死肿瘤细胞。疗程结束时,联合治疗组小鼠体质量甚至略高于对照组,经统计学检验差异有统计学意义(P<0.05),而5-FU+Canstatin低浓度组较5-FU+Canstatin高浓度组抑瘤率差异有统计学意义,但两组小鼠体质量经统计学分析差异统计学意义(P〉0.05)。 这可能是因为联合应用抗血管生成药和细胞毒药物,在未增加明显毒性反应情况下,增强了抗肿瘤疗效,使肿瘤负荷减轻所致,与Reimer[15]等研究发现血管生长抑制剂NM-3与5-Fu等多种常规化疗药物联合应用较化疗药物单独使用能够更明显地缩小移植瘤体积,而并不增加对机体的不良反应研究结果一致。canstatin 抑制血管生成的机制在于其能抑制整联蛋白/FAK 信号传导通路和PI3-K/Akt 信号通路[16],导致抗凋亡蛋白FL IP 蛋白合成下降,从而诱导内皮细胞凋亡。最近发现Canstatin 能通过胱冬酶原8和9 裂解,在线粒体凋亡机制中起重要作用[17],和细胞毒药物合用将产生相加作用。?
总之,笔者的研究证实,重组人Canstatin蛋白能有效抑制人结肠癌生长,其作用机制是抑制肿瘤新生血管形成,与细胞毒药物联合应用,能显著增强抗肿瘤效果,且不增加对机体的毒副作用,为结肠癌综合治疗开辟了新的途径,有良好的应用前景。?
[1] Go VL,Butrum RR,Wong DA.Diet,nutrition,and cancer prevention:the postgenomic era.J Nutr,2003,133(11):3830-3836.?
[2] Cappell MS.The pathophysiology,clinical presentation,and diagnosis of colon cancer and adenomatous polyps.Med Clin North Am,2005,89(1):1-42.?
[3] George DK,Pablo CC,David J,et al.Canstatin,a novel matrix-derived inhibitor of angiogenesis and tumor growth.J B iol Chem,2002,75(2):1209-1215.?
[4] Narazaki M,Tosato G.Canstatin:an inhibitor of angiogenesis and tumor growth revisited.Cancer J,2006,12:110-112.?
[5] Kamphaus GD,Colorado PC,Panka DJ,et al.Canstatin,a novel matrixderived inhibitor of angiogenesis and tumor growth.J Biol Chem,2000,275:1209-1215.?
[6] Hou WH,Wang TY,Yuan BM,et al.Recombinant mouse canstatin inhibits chicken embryo chorioallantoic membrane angiogenesis and endothelial cell proliferation.Acta Biochim Biophys Sin,2004,36:845-850.?
[7] 蒋日成,方唯意,冬毕华,等.重组人Canstatin的克隆、表达及其活性鉴定.肿瘤生物治疗杂志,2002,9(4):283-286.?
[8] 戴体俊.合并用药的定量分析.中国药通报,1998,14(15):479-480.?
[9] Weinder.Intratumor microvessel density as a prognostic factor in cancer.Am J Pathol.1995,147(1):9-19.?
[10] Folkman J.Tumor angiogenesis:therapeutic implications.N Engl J Med,1971,285:1182-1186.?
[11] Mahadevan V,Hart I R.Metastasis and angiogenesis.Acta Oncol,1990,29(1):97-103.?
[12] Fidler I J,Ellis L M.The implications of angiogenesis for the biology and therapy of cancer metastasis.Cell,1994,79(2):185-188.?
[13] Kamphaus GD,Colorado PC,Panka DJ,et al.Canstatin,a novel matrix derived inhibitor of angiogenesis and tumor growth.J Biol Chem,2000,275(2):1209-1215.?
[14] 李玉英,钱桂生,黄桂君,等.Canstatin基因表达载体的构建及其生物学效应研究.第三军医大学学报,2004,26(19):1723-1725.?
[15] Corinne L.Remer,Naoki Agata,et al.Antineoplastic effect of chemo therapeutic agents are potentiated by NM 3,an inhibitor of angiogenesis.Cancer Research,2002,62(3):78-785.?
[16] Panka DJ,Mier JW.Canstatin inhibits akt activation and induces fas dependent apoptosis in endot helial cells.J Biol Chem,2003,278(39)∶37632-37636.?
[17] Magnon C,Galaup A,Mullan B,et al.Canstatin acts on endot helial and tumor cells via mitochondrial damage initiated through interaction with alphavbeta3 and alphavbeta5 integrins.Cancer Res,2005,65(10)∶4353-4361.?











