医院分离致病菌的临床分布和耐药性监测
作者:李蓉 李文林 石小玉, 廖晚珍, 徐小文
【摘要】 【目的】 调查南昌大学第一附属临床分离致病菌的分布特点及对常用抗菌药物的耐药情况。【方法】 用Microscan-autoscan-?准型自动微生物分析仪鉴定到种并测定其对常用抗菌药物的最低抑菌浓度(MIC50),按美国临床实验室标准委员会(NCCLS)2003年版标准判断结果,利用WHONET5软件进行统计和分析。 【结果】 1344株菌中,革兰氏阳性(G+)菌占31.92%;革兰氏阴性(G-)菌占68.08%。最常见的G+菌有表皮葡萄球菌和金黄色葡萄球菌等;最常见的G-菌有大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、洛菲不动杆菌、短黄杆菌和阴沟肠杆菌等;细菌的分布以痰液中分离的最多(40.10%),其次为尿液(19.79%),分泌物占11.24%;主要来源于呼吸内科(11.53%)和ICU(10.79%)。药敏结果表明:利福平、万古霉素对常见G+菌效果较好,但利福平对金黄色葡萄球菌无效;头孢西丁、哌拉西林/他巴唑、亚胺培南和阿米卡星是治疗肠杆菌感染的首选药,但对阴沟肠杆菌无效;鲍曼不动杆菌和嗜麦芽假单胞菌对常用抗菌药物的平均耐药率分别为37.67%和56.15%。【结论】 细菌的多重耐药日趋严重,开展细菌耐药性监测,对指导临床合理使用抗生素,降低医院感染率和病死率有重要意义。
【关键词】 临床分离致病菌;抗菌药物;耐药率;耐药性监测
[J SUN Yat-sen Univ(Med Sci), 2007, 28(3):353-357] 近年来,随着抗菌药物,特别是广谱抗菌药物的不断推广,细菌的耐药性日益突出[1],且临床常见致病菌的种类在不断变迁;调查临床分离致病菌的种类、分布和耐药状况,对指导临床合理使用抗生素,降低医院感染率和病死率,减少滥用抗生素所导致的损失有重要意义[1]。本研究了南昌大学第一附属医院2004年5月至2004年11月间分离出1 344株菌株的耐药特点和分布,现将结果报告如下。
1 材料与方法
1.1 菌株来源
收集南昌大学第一附属医院2004年5月至2004年11月间的各类标本,包括:痰液、尿液、血液、粪便、创面分泌物、穿刺引流液、脑脊液等。临床分离致病菌共1 437株,排除同一病人相同部位先后分离的重复菌株,实际完成监测1 344株。
1.2 分离鉴定
按《全国临床检验操作规程》第2版对各种标本进行细菌分离、培养,用Microscan-autoscan-?准型自动微生物分析仪鉴定。
1.3 药敏试验
用Microscan-autoscan-?准型自动微生物分析仪通过微量稀释法直接报告临床分离致病菌对常用抗菌药物的MIC50,按美国临床实验室标准委员会(NCCLS)2003年版标准判断结果,质控菌为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853和金黄色葡萄球菌ATCC25923。
1.4 数据分析
用WHO全球细菌耐药性监测网提供的WHONET5软件进行统计分析。
2 结 果
2.1 细菌分布
2.1.1 菌种分布 在收集的1 344株临床分离致病菌中,G+菌429株,占31.92%,G-菌915株,占68.08%。在G+菌中最常见的是表皮葡萄球菌83株(6.18%),其次为金黄色葡萄球菌72株(5.36%)。在G-菌中最常见的是大肠埃希菌231株(17.19%),其次为肺炎克雷伯菌135株(10.04%)。其中,肠球菌和非发酵菌的分离率近年来呈上升趋势,值得关注(表1)。
2.1.2 标本分布 临床分离的1 344株致病菌中,痰液中分离的最多,有539株(40.10%);其次为尿液266株(19.79%);分泌物151株(11.24%);血液148株(11.01%);穿刺引流液98株(7.29%);粪便70株(5.21%);白带41株(3.05%);骨髓11株(0.82%)以及其它标本20株(1.49%)。常见菌种的标本分布见表1。
2.1.3 科别分布 从住院部和门诊所收集的1344株临床分离致病菌,主要来源于呼吸内科155株(11.53%);ICU145株(10.79%);门诊(7.66%);普外科89株(6.62%);儿科82株(6.10%);泌外科79株(5.88%);干部病房75株(5.58%);消化内科71株(5.28%);肾内科62株(4.61%)。
2.2 菌株对各种抗菌药物的耐药状况
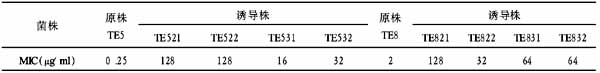
2.2.1 临床常见G+菌的耐药状况 常见葡萄球菌、肠球菌对各类常用抗生素均有较高的耐药率。葡萄球菌对氨苄西林和哌拉西林的总耐药率分别为94.73%和92.63%。值得注意的是溶血葡萄球菌对亚胺培南的耐药率为77.59%明显较强。但人葡人亚种对庆大霉素敏感;利福平、万古霉素对常见G+菌效果较好,但金黄色葡萄球菌对利福平的耐药率为30.56%(表2)。
2.2.2 临床常见肠杆菌的耐药状况 常见肠杆菌的临床耐药率高,除甲型副伤寒杆菌对各种常用抗生素敏感外,大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌和奇异变形杆菌对氨苄西林、哌拉西林、磺胺甲恶唑、头孢噻吩、头孢唑啉、头孢呋肟、氨曲南、头孢唑肟、头孢曲松、环丙沙星、头孢他啶、庆大霉素、氨苄西林/舒巴坦、妥布霉素、头孢吡肟的的总耐药率在40%~86%间;但奇异变形杆菌对头孢他啶和头孢唑肟敏感。阴沟肠杆菌对包括阿米卡星在内的所有常用抗生素均耐药;头孢西丁、哌拉西林/他巴唑、亚胺培南和阿米卡星是治疗肠杆菌感染的首选药,但对阴沟肠杆菌无效(表3)。
2.2.3 非发酵菌的耐药状况 非发酵菌的分离率呈上升趋势,占G-菌的23.74%。铜绿假单胞菌对哌拉西林、头孢曲松、头孢他啶、头孢唑肟和氨曲南的耐药率非常高,仅亚胺培南和阿米卡星有效;值得注意的是鲍曼不动杆菌对包括亚胺培南在内的常用抗生素都耐药,平均耐药率高达37.67%;洛菲不动杆菌对除磺胺甲恶唑外的常用抗生素均敏感;短黄杆菌对哌拉西林和环丙沙星敏感;嗜麦芽假单胞菌对常用抗生素均高度耐药(表4)。
3 讨 论
自2004年5月至2004年11月从南昌大学第一附属检验科共分离出致病菌1 344株,其中革兰氏阳性菌429株,占31.92%,革兰氏阴性菌915株,占68.08%。临床致病菌以痰液中分离的最多,主要来源于呼吸内科和ICU,这主要是由于呼吸内科和ICU的病人呼吸道分泌功能减退,纤毛运动减弱,不能及时排痰,加上气管插管、静脉插管、使用呼吸机、长期使用广谱抗生素后[2],导致菌群失调,耐药率高的G-菌定植生长。
G+菌中,肠球菌的分离率高达8.92%,高于成都等地区[3],葡萄球菌对包括亚胺培南在内的多种抗菌药物耐药,在治疗G+菌感染时,可考虑使用利福平(金黄色葡萄球菌除外)和万古霉素。
对G-菌的监测结果表明:头孢西丁、哌拉西林/他巴唑、亚胺培南和阿米卡星是治疗肠杆菌感染的首选药,但对阴沟肠杆菌无效,阴沟肠杆菌对头孢西丁和亚胺培南的耐药率分别为97.06%和91.18%,高于广州[4]和成都地区[3];不动杆菌产生抗生素多重耐药性通常是临床感染的一个特点[5],碳青霉烯是治疗严重不动杆菌感染的适合药物,但也可能出现对碳青霉烯的耐药[6],本次分离的鲍曼不动杆菌对亚胺培南的耐药率为26.04%,明显高于成都、广州、温州等地区[3,4,7,8],这与近年本院在重度感染病人中广泛应用亚胺培南有关。洛菲不动杆菌对磺胺甲恶唑的耐药率高达40.43%,短黄杆菌和嗜麦芽假单胞菌对氨曲南、庆大霉素、妥布霉素和阿米卡星的平均耐药率分别为82.5%和89.66%。铜绿假单胞菌对青霉素、头孢三代和氨曲南的平均耐药率为86.54%,与院内病原菌耐药监测结果符合[8]。
近20年来,细菌的耐药谱越来越广,应注意在获得培养和药敏实验结果后再选择性的治疗[9],并据引起爆发的耐药菌改变抗生素并注意抗生素循环使用[10]。反复的单一抗生素治疗(特别是用同一类抗生素)可促进抗生素耐药性的扩散。
【】
张婴元.细菌耐药趋势与抗感染治疗的若干问题[J].医学杂志,2001,81(1):2-4.
SALGADO C D, O′GRAGY N, FARR B M. Prevention and control of antimicrobial-resistant infections in intensive care patients [J]. Crit Care Med, 2005, 33(10):2373-2382.
苗 佳,梁德荣,陈慧莉,等. 2001年成都地区1819株临床分离菌耐药性监测 [J]. 中国抗生素杂志,2003,28(2):101-105.
陈冬梅, 陈求刚, 廖 康,等. 院内常见革兰氏阴性杆菌耐药性监测[J].中国抗生素杂志, 2001,26(6):473-476.
JOSHI S G, LIAKE G, GHOLE V S, et al. Plasmid- borne extended-spectrum [beta]- lactamase in a clinical isolate of Acinetobacter baumannii [J]. J Med Microbiol, 2003, 52(12): 1125-1127.
HODLE A E, RICHTE K P, THOMPSON R M.Infection control practices in U.S. burn units [J]. J Burn Care Res, 2006, 27(2): 142-151.
潘发愤,李庆兴,郑 宇,等. 非发酵菌感染临床分布和耐药性变迁及治疗对策的研究 [J]. 中国抗生素杂志,2001,26(5):362-364.
CLACK, NINA M, PATTERSON J, et al. Antimicro bial resistance among Gram-negative organisms in the intensive care unit[J]. J Curr Opin Crit Care, 2003, 9(5): 413-423.
BIN D, DECHANG C, DAWEI L, et al. Restriction of third-generation cephalosporin use decreases infection-related mortality[J]. Crit Care Med, 2003, 31(4):1088-1093.
WEINSTEIN R A, BONTEN M J. Controlling antibiotic-resistant bacteria:What′s an intensivist to do? [J]. Crit Care Med, 2005, 33(10):2446-2447.