非小细胞肺癌术后辅助化疗的共识
【摘要】 近年来有关非小细胞肺癌术后辅助化疗的标准发生了显著变化,越来越多的前瞻性、大样本随机临床试验和多项荟萃分析均证实辅助化疗,特别是新一代化疗药物的含铂联合方案能显著提高化疗反应和总体生存期,降低死亡危险比,且毒性反应均可耐受。因此,对于完整手术后的非小细胞肺癌,特别是ⅠB~Ⅱ期的患者采用辅助化疗是合理治疗方案。
【关键词】 非小细胞肺癌 辅助化疗
Postoperative Adjuvant Chemotherapy for Non-Small Cell Lung Cancer
Abstract: Recently the standard of postoperative adjuvant chemotherapy for non-small cell lung cancer has significantly changed.More and more large scale and prospective randomized clinical trials and Meta-analyses have proved that adjuvant chemotherapy, especially new generation of chemotherapeutic agents combined with platinum can significantly improve the median and overall survival. It also can decrease the hazard ratio for death and its toxicity is tolerable.Therefore adjuvant chemotherapy is a optimal therapy for patients with non-small cell lung cancer completely resected, especially in stage ⅠB and Ⅱ.
Key words: non-small cell lung cancer;adjuvant chemotherapy
肺癌对人类健康的威胁日益严重,肺癌的发病率、死亡率大幅度上升,2002年全世界有135万新发病例,118万因肺癌相关死亡[1]。非小细胞肺癌是肺癌中最常见的一种类型,占肺癌的80%~85%,外科手术切除是治疗可手术的非小细胞肺癌最好的方法,但仅20%~30%左右肺癌病人就诊时适宜手术,按1997年国际分期,ⅠA期术后5年生存率61%,ⅠB期38%,ⅡA期34%,ⅡB期24%,ⅢA期13%,ⅢB期5%[2]。手术治疗失败的主要原因是术中局部切除不彻底,术前已有潜在的转移灶和多个播散的微小转移灶导致局部复发和远处转移,而且术后患者机体免疫功能降低[3]。
合理、系统、有效的多学科综合治疗,包括化疗可以使死亡危险比降低13%,有助于延长生存期[4]。20年来,非小细胞肺癌采用辅助化疗,特别是早期非小细胞肺癌的治疗效果仍然是不明确的,一直存在争议。第一代临床试验设计不完善,使用的化疗药物有效率不高。第二代临床研究以老的化疗药物与铂类联用,但是研究的样本量太小,不足以监测疗效。1995年非小细胞肺癌协作组(non-small cell lung cancer collaborative group,NSCLCCG)的荟萃分析包括了52项随机研究,包括了非含铂化疗方案5个随机研究,最后得出的结论是长期使用烷化剂(alkylating agent)术后化疗对患者有害,相对死亡危险比增加15%,5年生存率降低5%。对含铂化疗方案的分析(包括8个随机研究),最后得出的结论是辅助性含铂化疗方案对患者的生存有轻微益处,相对死亡危险比减少13%,5年生存率增加5%,但无统计学差异(P=0.08)[5]。虽然,这种改善没有达到统计学差异,但是它点燃了人们对于手术后非小细胞肺癌化疗的兴趣。近2年来, 越来越多的前瞻性、大样本随机临床试验和多项荟萃分析均证实辅助化疗,特别是新一代化疗药物的含铂联合方案能显著提高化疗反应和总体生存期,有关非小细胞肺癌的辅助化疗的治疗标准发生了显著变化,本文就目前随机临床试验进展做一综述。
1 ALPI临床试验
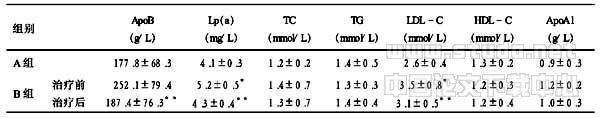
2003年意大利的辅助化疗试验(ALPI)是继1995年NSCLCCG荟萃分析发表后第一个大样本的辅助化疗的临床研究。入选1 088例完全手术切除的Ⅰ、Ⅱ、ⅢA期非小细胞肺癌患者,随机分为丝裂霉素+长春酰胺+顺铂三个周期的化疗组和对照组,化疗组丝裂霉素8mg/m2 d1,长春酰胺3mg/m2 d1、8,顺铂100mg/m2 d1,21 d为一周期,共3个周期。中位随访时间64.5个月,试验结果为化疗组在改善总体生存率上无统计学差异。在该研究中,43%的患者给予术后放疗,69%的患者完成了所有3个周期的化疗,但是,化疗组在第1年的死亡率高于对照组。但Ⅱ期患者化疗组与对照组比较,在无疾病进展期和总体生存期这两项指标上有一定得益,危险比分别为0.78(95%可信区间0.60~1.03)和0.80(95%可信区间0.60~1.06),但未见统计学差异 [6]。
2 2003年国际肺癌辅助化疗试验(IALT)
IALT 试验包括了1 867例患者,均为完整手术后的Ⅰ、Ⅱ或Ⅲ期非小细胞肺癌患者。中位随访时间56个月,结果显示:以铂类为基础的两药联合方案与对照组相比,5年生存率提高4%(44.5% vs 40.4%,P<0.03),减少了14%的死亡危险比。其中25%的患者接受了术后放疗,74%接受了至少240 mg/m2体表、面积的顺铂化疗[7],但是化疗组与对照组患者的一般特征(年龄、性别)、治疗方案、临床特征(分期、手术方式、病理分型、PS评分)等方面未见统计学差异。
3 JBR10临床试验
加拿大NCI的JBR10试验包括482例患者,ⅠB期(T2N0)或Ⅱ期(T1N1或T2N1)非小细胞肺癌,随机分为4个周期的诺维本+顺铂组和对照组。所有患者在手术后6周内开始辅助化疗,顺铂50mg/m2 d1、8,28d为一周期,共4个周期;诺维本25 mg/m2 d1,7 d为一周期,共16个周期。患者PS评分0~1分。化疗没有导致过度的毒性反应(只有2例治疗相关性的死亡事件),化疗组的依从性较好,58%的患者接受了3个周期化疗,48%接受了4个周期化疗。中位随访时间超过5年,与对照组相比,辅助化疗组的5年生存率提高15%(69% vs 54%,P=0.03),死亡危险率降低了31%(P=0.04)[8]。这是第一个对所有患者采用第三代化疗方案的临床试验,它也是迄今为止辅助化疗提高生存率最高的报道。
4 CALGB9633临床试验
美国肿瘤和白血病B组的CALGB9633临床验针对于ⅠB期的非小细胞肺癌患者344例,随机分为4个周期的辅助化疗和对照组。化疗方案为:泰素200 mg/m2,伯尔定AUC=6; 3周1次,共4个周期。患者的耐受性良好,没有出现治疗相关性死亡,85%的患者完成了4个周期的化疗。中位随访时间4年,试验结果与对照组比较,辅助化疗组的4年生存率提高12%(71%vs 59%),所有原因引起的死亡降低38%,肺癌引起的死亡率下降49%(P=0.018),第4年因肺癌而死亡降低11%,总体降低31%的复发风险,第4年的无病生存率绝对值提高11%[9]。
5 ANITA临床试验
ANITA试验包括840例完全手术的ⅠB、Ⅱ或ⅢA期非小细胞肺癌患者,随机分为4个周期的诺维本+顺铂组和对照组。和JBR10试验的结果相似,化疗的毒性反应可以耐受,中位随访时间超过70个月,辅助化疗组5年生存率提高8%(51%vs 43%),死亡危险率下降21%[10];7年生存率提高8.4%(45.2%vs 36.8%,P=0.013)。
6 日本肺癌研究组优福定辅助化疗临床试验
日本的一项术后非小细胞肺癌患者辅助优福定(UFT)化疗的Ⅲ期临床试验,包括了979例T1N0或T2N0的腺癌患者,中位随访时间73个月,每天口服优福定250 mg/m2×2年,结果5年生存率提高3%(88%vs 85%,P=0.047),其中T2组的5年生存率提高11%(85%vs 74%,P=0.005)[11]。而另一项有关术后非小细胞肺癌患者辅助优福定(UFT)化疗的荟萃分析,包括了9个临床试验,其中6个有手术对照组和术后辅助化疗UFT组,2个为三组研究方案,手术+顺铂为基础化疗+UFT组。2 003例患者入选,98.8%为鳞癌或腺癌,T1为1 308例(65.3%),T2为674例(33.6%),N0为1 923例(96.0%),中位随访时间6.44年,与单纯手术组比较,辅助化疗组的5年生存率提高4.3%(81.5%vs 77.2%,P=0.11),7年生存率提高7%(76.5%vs 69.5%,P=0.001)。对于Ⅰ期(特别是T2N0)腺癌的日本患者,口服UFT能显著改善总体生存率[12]。
7 小 结
随着对非小细胞肺癌患者采用辅助化疗能得到益处的证据不断出现,围绕它的争论也就尘埃落定了。ⅠB~Ⅱ期完全手术后的非小细胞肺癌采用辅助化疗是标准方案[13]。推荐使用以铂类为基础的两药联用方案和第三代抗肿瘤药物,UFT在日本显示了强有力的证据对ⅠB期患者有效[14]。上述随机临床试验的结果虽然为辅助化疗ⅠB、Ⅱ期和ⅢA期NSCLC的有效性以及提高治愈率方面提供了合理而强有力的证据,但是仍然有许多问题值得我们继续去探求:如哪些患者适合术后辅助化疗?辅助化疗常规选择何方案?术后辅助化疗的最佳治疗周期?如何提高辅助化疗的依从性及治疗效益?分子靶向药物如何整合至术后的辅助治疗中等等,这些都期待更多的临床试验解决。
【】
[1] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics,2002[J]. Cancer J Clin, 2005,55:74-108.
[2] Mountain CF. Revisions in the international system for staging lung cancer[J]. Chest,1997,111(6):1710-1717.
[3] Maruyama R,Sugia K,Mitsudomi T, et al. Relationship between early recurrence and micrometastases in the lymph nodes of patients with Ⅰ non-small cell lung cancer[J].J Thorac Cadiovasc Surg,1977,114:535-543.
[4] Bunn PA, Soriano AF.Chemotherapeutic options in lung cancer[J]. Cancer, 1998,83:1740-1750.
[5] Non-small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer:a meta-analysis using updated data on individual patients from 52 randomised clinical trials[J]. BMJ, 1995,311:899-909.
[6] Scagliotti GV, Fossati R, Torri V, et al. Randomized study of adjuvant chemotherapy for completely resected stage Ⅰ,Ⅱ,or ⅢA non-small cell lung cancer[J]. J Natl Cancer Inst, 2003,95:1453-1461.
[7] The International Adjuvant Lung Cancer Trial Collaborative Group.Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer[J]. N Engl J Med, 2004,350:351-360.
[8] Winton T,Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs observation in resected non-small cell lung cancer[J]. N Engl J Med, 2005,352:2589-2597.
[9] Strauss GM, Herndon J, Maddaus MA, et al. Randomized clinical trial of adjuvant chemotherapy with paclitaxel and carboplatin following resected in stage ⅠB non-small cell lung cancer(NSCLC):report of Cancer and Leukemia Group B(CALGB) protocol 9633[J]. J Clin Oncol, 2004,22(Suppl 14S):612.
[10] Douillard JY, Rosell R, Delena M, et al. ANITA:Phase Ⅲ adjuvant vinorelbine and cisplatin versus observation in completely resected (stageⅠ~Ⅲ ) non-small cell lung cancer patients:final results after 70-month median follow-up[J]. J Clin Oncol, 2005,23(Suppl 16s):624.
[11] Kato H, Ichinose Y, Ohta M, et al. A randomized trial of adjuvant chemotherapy with uracil-tegafur for adenocarcinoma of the lung[J]. N Engl J Med, 2004,350:1713-1721.
[12] Hamada C, Tanaka F, Ohta M, et al. Meta-analysis of postoperative adjuvant chemotherapy with tegafur-uracil in non-small-cell lung cancer[J]. J Clin Oncol, 2005, 23(22):4999-5006.
[13] Katherine MW. Pisters. Adjuvant chemotherapy for non-small-cell lung cancer—the smoke clear[J]. N Engl J Med, 2005,352:2640-2642.
[14] Kato H, Tsuboi M, Kato Y, et al. Postoperative adjuvant therapy for completely resected early stage non-small cell lung cancer[J][In Process Citation]. Int J Clin Oncol (Japan), 2005, 10(3) :157-164.