慢性HCV感染患者PBMC体外Th1类细胞因子分泌及其相关因素分析
作者:李跃旗,许鹏辉,苏海滨 ,迟淑萍,朱雷,戚扬,李金波,程云
【摘要】 目的:研究慢性HCV(丙型肝炎病毒)感染患者外周血单个核细胞(PBMC)体外Th1类细胞因子的分泌,进一步了解HCV感染慢性化和肝损伤机制. 方法:体外培养慢性HCV感染患者PBMC 72 h后,ELISA检测培养上清Th1类细胞因子(IL?2,IFN?γ,TNF?α),荧光定量PCR检测患者血清HCV RNA含量,RT?PCR检测HCV RNA亚型. 结果:与正常人相比,IFN?γ在HCV RNA阴性患者中明显增高,而在RNA阳性患者中无明显升高. TNF?α则不论RNA滴度的高低均较正常人显著增高. RNA阳性患者ALT(丙氨酸氨基转移酶),AST(门冬氨酸氨基转移酶)水平明显高于阴性患者. 不同HCV基因型感染的患者IFN?γ,TNF?α的分泌无显著差异. 结论:IFN?γ在清除病毒中起重要作用,TNF?α是引起肝脏损伤的重要因素之一.
【关键词】 C型肝炎样病毒属
0引言
HCV(丙型肝炎病毒)感染后易于慢性化,但其慢性化机制仍不十分清楚. 有研究[1-2]表明,天然免疫、体液免疫以及细胞免疫均对病毒的清除有重要作用,而细胞免疫尤为重要. Th1类细胞因子是参与细胞免疫的重要物质,在细胞清除细胞内病原体的免疫应答过程中起关键作用,但同时也是诱发肝脏损伤的重要机制. 我们比较了HCV感染后体内不同病毒滴度及不同的基因型患者的外周血单个核细胞(PBMC)体外分泌Th1类细胞因子及肝脏的炎症情况,以进一步了解HCV感染慢性化和肝损伤机制.
1对象和方法
1.1对象收集我院2005年门诊或住院的慢性HCV感染患者44(男35,女9)例, 平均年龄42.3(15~67)岁,所有病例均符合2000年西安全国第十次病毒性肝炎及肝病学术会议修订的《病毒性肝炎防治方案》慢性HCV感染诊断标准[3]. 对照10例为健康献血员. 淋巴细胞提取液、Trizol、细胞因子ELISA检测试剂盒(晶美公司);AMV(逆转录酶),RNA酶抑制剂、dNTP,Taq酶(Promega公司);RPMI 1640母液(Gibico公司);GeneAMP5700型HCVRNA定量检测仪(美国ABI公司);AU600肝功能检测仪(Olympus公司);其他试剂均购自北京中生公司产品.
1.2方法
1.2.1外周血PBMC的提取采用Ficoll梯度离心法.
1.2.2PBMC体外培养后上清细胞因子的检测将分离所得PBMC用含有100 mL/L混合人血清的完全RPMI 1640培养液稀释细胞密度为5×109/L,以100 μL/孔加于96孔板,37℃,50 mL/L CO2孵箱中培养,72 h后收集培养上清,-20℃冻存. 同时设不加细胞的阴性对照和加入ConA(刀豆蛋白,2 mg/L)刺激的阳性对照.
1.2.3检测项目全部病例采用荧光定量PCR检测HCV RNA滴度,肝功能检测由我院临床检验中心完成.
1.2.4血清HCV RNA基因分型参照[4]进行. Trizol提取血清中总RNA,逆转录合成cDNA,引物:5′?ATGTACCCCATGAGGTCGGC?3′. 巢式PCR进行RNA分型鉴定. 第1轮PCR引物:正义:5′?CGCGCGACTAGGAAGACTTC ?3′;反义:5′?ATGTACCCCATGAGGTCGGC?3′,94℃变性1 min,55℃复性1.5 min,72℃延伸2 min,35个循环. 第2轮PCR以第1轮PCR产物为模板,使用同一个正义引物和4个型特异性反义引物,正义:5′?AGGAAGAC TTCCGAGGGGTC?3′,反义:5′?TGCCTTGGGGATAGGCTGAC?3′(Ⅰ型,57 bp);5′?GAGCCATCCTGCCCACCCCA ?3′(Ⅱ型,144 bp);5′?CCAAGAGGGACGGGAACCTA?3′(Ⅲ型,174 bp);5′?ACCCTCGTTTCCGTACAGAG ?3′(Ⅳ,135 bp),94℃变性1 min,60℃复性1 min,72℃延伸1.5 min,30个循环. PCR产物15 g/L琼脂糖凝胶电泳鉴定.
统计学处理:用STATA7.0软件进行统计学处理,两组间比较采用t检验.
2结果
2.1HCV感染患者PBMC体外培养72 h后Th1类细胞因子的分泌培养72 h后,对照及所有HCV患者PBMC培养上清中均未检测到IL?2. HCV RNA阴性(RNA<106拷贝/L)患者IFN?γ[(55±33) ng/L]较正常人[(34±14) ng/L ]和RNA大于109拷贝/L的患者[(29±20) ng/L]明显增高(图1),而所有RNA阳性患者与对照相比无显著差异. TNF?α不论RNA滴度高低均较对照显著增高;RNA不同滴度的患者间无显著差异.
2.2不同HCV RNA滴度情况下患者肝脏功能间的比较RNA阳性患者ALT,AST水平明显高于阴性患者(表1),其余肝脏功能指标两组患者间无明显差异.
2.3不同HCVRNA基因型Th1类细胞因子的分泌对34例HCV RNA阳性患者进行HCV RNA分型,21例Ⅱ/1b(62%),5例Ⅲ/2a(15%),8例(23%)未分出(表2). 不论HCV RNA为何种基因型,PBMC体外培养后IFN?γ的分泌都较对照组无显著差异,而TNF?α则均较对照组明显增高. 但各基因型之间IFN?γ,TNF?α均无显著差异.
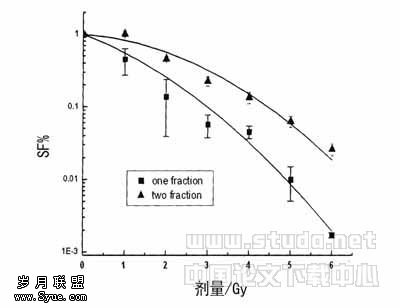
图1在不同HCV RNA滴度下的PBMC IFN?γ和TNF?α的分泌水平 略
表1不同HCV RNA滴度情况下患者的肝脏功能(略)
表2不同的HCV RNA基因型Th1类细胞因子的分泌(略)
3讨论
虽然HCV感染后可诱导机体产生特异性的抗体,但HCV感染仍倾向于慢性化,可能原因是HCV在免疫压力的诱导下中和性表位发生变异,致使已产生的抗体不能中和病毒[5]. 因此,细胞免疫在HCV感染后的清除过程中可能起到决定性作用[6]. 有研究表明,在感染HCV后自发清除病毒的患者中,其体内Th1类细胞因子(IFN?γ,TNF?α)的产生显著高于病毒持续存在的患者[7]. 此外,在HCV感染后不论是否清除病毒,均可诱导机体产生特异性的细胞免疫,但免疫应答的强度不足以清除病毒,从而致使病毒长期存在[8].
IFN?γ主要由NK细胞、CD8+T淋巴细胞、CD4+T淋巴细胞分泌,可增强抗原提呈细胞的吞噬能力,促进MHCI,II类抗原的表达、IL?12的分泌,诱导机体免疫应答向Th1类分化[9],同时其本身也具有抗病毒作用. 我们的实验表明,慢性HCV感染患者PBMC体外培养后,在HCVRNA阴性(<106拷贝/L)患者中,IFN?γ,TNF?α的产生明显高于正常人,而在HCVRNA阳性患者中,不论滴度的高低,TNF?α均有所升高,但IFN?γ的产生却与正常人无显著差异,且HCVRNA滴度越高,IFN?γ的产生越低. 这在一定程度上表明,IFN?γ在病毒清除中起重要作用,细胞因子(IFN?γ,TNF?α)分泌的不平衡可能是导致病毒不能清除的原因之一.
细胞免疫在HCV感染中具有双重作用,HCV感染后诱导机体产生的Th1类细胞因子(IFN?γ,TNF?α)虽然不足以清除病毒,但仍可诱导机体肝脏损伤[10]. IFN?γ,TNF?α同时具有抗病毒和明显的诱发炎症作用,在HCV感染后引起肝脏损伤中起重要作用. 我们的实验发现,在RNA阳性患者中,代表肝脏炎症指标的ALT,AST较RNA阴性患者明显增高,且TNF?α也较正常人明显增高,表明RNA含量与病毒引起的肝脏损伤有一定关系,这可能由于在RNA阳性患者中,由于IFN?γ分泌不足,单独的TNF?α升高表现为肝损伤为主,但不足以清除病毒. 而在RNA阴性、肝功能正常的患者,虽然TNF?α也明显增高,但IFN?γ同时增高,二者一同起到了抗病毒的协同作用,体内病毒含量的减少使得肝脏炎症减轻. 另外,虽然RNA阴性患者表现为ALT,AST正常,但其诱导产生的免疫应答仍有可能造成损伤,肝脏炎症依然存在,病理检查将有助于进一步的明确.
在我国,HCV基因型Ⅱ/1b,Ⅲ/2a为主要感染病毒株,在我们的研究中基因型Ⅱ/1b,Ⅲ/2a占RNA阳性患者的76%,各基因型之间IFN?γ,TNF?α的分泌均无显著差异,提示慢性HCV感染后诱导产生的免疫应答与基因型无关.
【】
[1] Mizukoshi E, Rehermann B. Immune responses and immunity in hepatitis C virus infection[J]. J Gastroenterol, 2001, 36(12): 799-808.
[2] Thimme R, Lohmann V, Weber FA. Target on the move: Innate and adaptive immune escape strategies of hepatitis C virus[J]. Antiviral Res, 2006,69(3): 129–141.
[3] 中华医学会传染病与寄生虫病学分会、肝病学分会. 病毒性肝炎防治方案[J].中华肝脏病杂志, 2000, 8(6):249-250.
[4] Hiroaki O, Yasushi S, Shunichi O, et al. Typing hepatitis C rirus by polymerase chain reaction with type?specific primers: Application to clinical surveys and tracing infectious sources[J]. J General Virol, 1992, 73(3): 673-679.
[5] Pavio N, Lai MM. The hepatitis C virus persistence: how to evade the immune system? [J]. J Biosci, 2003, 28(3): 287-304.
[6] Christie JM, Healey CJ, Watson J, et al. Clinical outcome of ypogammaglobulinemic patients following outbreak of acute hepatitis C: 2 Year followup[J]. Clin Exp Immunol, 1997, 110(1): 4-8.
[7] Rosen HR, Miner C, Lewinsohn D, et al. Frequencies of HCV?specific effector CD4 T cells by flow cytometry: Correlation with clinical disease stages[J]. Hepatology, 2002, 35(1): 190-198.
[8] Rosen HR. Hepatitis C Pathogenesis: Mechanisms of Viral Clearance and Liver Injury[J]. Liver Transplant, 2003, 9(11): S35-S43.
[9] Szabo SJ, Sullivan BM, Peng SL, et al. Molecularmechanisms regulating Th1 immune responses[J]. Annu Rev Immunol, 2003, 21: 713-758.
[10] Sun J, Li K, Shata MT, et al. The immunologic basis for hepatitis C infection[J]. Curr Opin Gastroenterol, 2004, 20(6): 598-602.