脑缺血/再灌注诱导大鼠信号转导与转录激活子-1的变化
作者:李洪春,马萍,徐凯,杨春
【摘要】 目的 探索局灶脑缺血/再灌注不同时间诱导大鼠缺血中心区(同侧皮层)和周围区(同侧纹状体)信号转导与转录激活子-1(STAT1)的激活变化。方法 采用SD雄性大鼠线栓法制作右大脑中动脉缺血(MCAO)局灶脑缺血模型。运用抗STAT1和抗磷酸化STAT1抗体做免疫印迹(IB)检测缺血2h再灌注不同时间缺血中心区和周围区STAT1的表达及激活变化。结果 缺血2h再灌注不同时间,缺血中心区及周围区STAT1的磷酸化水平显著增加,再灌注24h达到峰值,与假手术组相比分别增加约3.1和3.8倍(P<0.05),但在整个再灌注过程中其蛋白表达并没有明显的变化。结论 局灶脑缺血再灌注能引起缺血中心区和周围区STAT1磷酸化水平的显著增加,提示缺血性脑损伤诱导STAT1的激活可能参与缺血同侧皮层及纹状体神经元细胞的病理生理过程。
【关键词】 MCAO;局灶脑缺血;信号转导与转录激活子-1(STAT1)
STAT1 was induced following focal cerebral ischemia/reperfusion in rats
【Abstract】 Objective To investigate the activation of signal transducer and activator of transcription-1(STAT1) after focal brain ischemia in the lesion core (cerebral cortex) and lesion periphery(striatum). Methods Middle cerebral artery occlusion (MCAO) ischemia model of SD rats was used in this study. The content of STAT1 protein and changes of p-STAT1 in the cerebral cortex and striatum homogenates were assessed by immunoblotting(IB) using anti-STAT1 and anti-p-STAT1 (Tyr 701) antibodies.Results The expression of STAT1 protein was not significantly altered during ischemia 2h and reperfusion different time,but phosphorylation levels of STAT1 was continuously increased and peaked at 24h of reperfusion in the cortex and striatum (3.1-and 3.8-folds vs sham respectively). Conclusion The activation of STAT1 was induced in the lesion core and lesion periphery following focal cerebral ischemia. The increments of p-STAT1 could involve in the changes of pathophysiology in the nervous cells.
【Key words】 focal cerebral ischemia; signal transducer and activator of transcription-1 (STAT1); middle cerebral artery occlusion (MCAO)
STAT1作为信号转导与转录激活子(Signal Transducers and Activators of Transcription,STATs)家族的成员之一,在IFN-γ介导的生物学效应中起到必不可少的作用,并介导多种细胞因子、生长因子、激素等从细胞表面受体并转入核内的胞内信号,它是一种具有信号转导与转录激活双重功能的蛋白质,存在于多种类型的组织和细胞中,它的激活与免疫反应和细胞生长抑制有关[1]。以往的研究表明多种应激因素包括热、活性氧、缺血等都能激活STAT1[2~4]。本实验运用MCAO(middle cerebral artery occlusion)局灶脑缺血模型,研究缺血中心区皮层和周围区纹状体,在缺血2h再灌注不同时间引起的STAT1的快速激活,旨在探索STAT1在缺血性脑损伤中的病理反应机制。
1 材料与方法
1.1 试剂 抗STAT1抗体(M-22,sc-592)为Santa Cruz Biotechlogy产品,抗p-STAT1单克隆抗体(Tyr701,#9171)购自Cell Signalling公司。Na3VO4和Leupeptin等所有蛋白抑制剂为Sigma产品。硝酸纤维素薄膜(NC膜)为Pharma?cia产品。HEPES为Amresco产品。其余试剂为国产分析纯。
1.2 动物及脑缺血模型 雄性Sprague Draley (SD) 大鼠18只(徐州医学院实验动物中心提供),体重250~320g,随机分为三小组。采用Longa等[5]线栓改良法建立SD大鼠单侧大脑中动脉缺血(MCAO)模型,即10%水合氯醛(0.3ml/100g)腹腔注射麻醉,钝性分离右颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。结扎CCA、ECA,微动脉夹夹闭ICA,在CCA近动脉分叉处剪破一小口,插入栓线,栓线进深距CCA分叉处约18~20mm,松开微动脉夹,在ICA根部结扎,栓线的末端留在皮肤外,再灌注时从颈内动脉抽出栓线即可,栓塞性缺血2h分别再灌注0、0.5、1、2、4、6、24h。假手术组栓线进深为5mm,不插入颈内动脉。
缺血后神经系统表现按照Longa的5分制评分标准进行评分,0分:无神经缺损症状;1分:对侧前肢不能完全伸展;2分:向对侧旋转;3分:向对侧倾倒;4分:不能自发走,意识丧失。1~4分为动物缺血模型成功的标志。
1.3 样本制备和测定 于缺血/再灌注(ischemia/reperfusion,I/R)不同时间点,立即断头取脑,根据MRI表现取材(文章另发表),迅速分离出缺血侧大脑中动脉区中心区皮层和周围区纹状体,液氮冻存备用。
以下操作均在冰水中进行,从液氮中取出标本加0.7ml匀浆缓冲液[含HEPES 20mmol/L,(pH 7.9),NaCl 400mmol/L,EDTA 1mmol/L,DTT 1mmol/L,Na3VO4 1mmol/L,PNPP 1mmol/L,PMSF 0.5mmol/L及蛋白抑制剂 Leupeptin、 Pepstatin 、 Aprotinin各10mg/L]。用Teflon匀浆机高速匀浆,加10%的NP-40 40μl,冰浴30min,15000g×30min离心,小心移取上清液,测蛋白后分装,置-80℃冰箱待用。
1.4 蛋白质含量测定 参照以前的方法[6],以牛血清白蛋白为标准蛋白。
1.5 蛋白质免疫印迹检测(IB) 参照以前的方法[6],即等量蛋白样品(100μg)经10%SDS-聚丙烯凝胶电泳(SDS-PAGE)分离后,以湿转法电转移至NC膜上,转移后的NC膜经3% BSA封闭后加入不同的稀释好的一抗(抗STAT1多抗1:100,抗p-STAT1抗体1:1000),4℃过夜,洗膜后加入相应的二抗(羊抗鼠Ig-AP,1:1000),37℃反应2h;以NBT/BCIP显色,结果以图像处理仪(Gene Company)处理。
1.6 统计学方法 数据以均数±标准差(x±s)表示,统计分析采用单因素方差分析(ANOVA),多实验组与一个对照组比较采用最小显著差法(LSD),多个实验组之间比较采用q检验(Newman-keuls test),P<0.05为统计学差异有显著性。
2 结果
2.1 缺血2h再灌注不同时间缺血中心区皮层STAT1的表达及激活变化 采用免疫印迹法分析假手术(Sham)、I 2h/R 0、I 2 h/R 0.5 h、I 2h/R 1h、I 2h/R 2h、I 2h/R 4h,I 2h/R 6h,I 2h/R 24h缺血中心区皮层匀浆核抽提液STAT1的蛋白表达及磷酸化水平(图1)。结果显示缺血2h再灌注不同时间并不能影响皮层STAT1蛋白表达水平,而STAT1的磷酸化水平则持续增加,再灌注24h达峰值,约为假手术组的3.1倍。
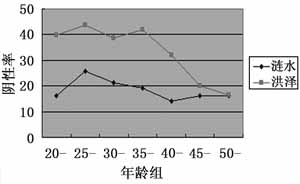
图1 缺血2h再灌注不同时间同侧皮层
STAT1表达及激活变化(A.局灶脑缺血2h再灌注不同时间同侧皮层STAT1、p-STAT1的免疫印迹图;B.半定量分析结果,与假手术组含量比较:*P<0.05)
2.2 缺血2h再灌注不同时间缺血周围区纹状体STAT1的表达及激活变化 以抗STAT1和p-STAT1抗体作免疫印迹检测缺血周围区纹状体匀浆核抽提液中STAT1的表达及磷酸化水平,结果显示缺血2h再灌注0、0.5、1、2、4、6、24h,缺血周围区纹状体组织中STAT1蛋白表达水平并没有明显的变化,而磷酸化水平则持续显著增加,再灌注24h时达高峰,其增加量约为假手术组的3.8倍(图2)。
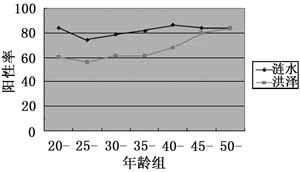
图2 缺血2h再灌注不同时间同侧纹状体
STAT1的表达及激活变化(A.局灶脑缺血2h再灌注不同时间同侧纹状体STAT1、p-STAT1的免疫印迹图;B.半定量分析结果,与假手术组比较:*P<0.05,n=3)
3 讨论
STAT-1在脑组织中广泛分布,在脑缺血过程中细胞凋亡是重要的细胞死亡机制,缺血性脑损伤引起大量细胞因子及生长因子的释放,如IL-6、TNF-α等。以往的研究表明,脑缺血的刺激激活了JAKs-STATs信号通路。本研究我们采用SD大鼠线栓法右大脑中动脉缺血(MCAO)局灶脑缺血模型,运用免疫印迹法分析表明,缺血2h再灌注不同时间,缺血中心区皮层STAT1的蛋白表达水平虽无明显变化,但其磷酸化水平却持续显著增加,再灌注24h时达高峰,一方面可能与脑缺血时细胞的ATP被耗竭,即所谓的细胞能量衰竭[7],再灌注后ATP水平显著升高有关。另一方面,在急性脑缺血再灌注后反应性活性氧(reactive oxygen species,ROS)的过多产生,常常超过抗氧化酶的能力造成氧化应激和细胞破坏,ROS是缺血性神经元凋亡的多效介导者,可以导致钾通道调节的血管扩张,改变血管的反应性、局灶性的内皮损伤和血脑屏障的破坏,促进细胞的凋亡,且在血管平滑肌细胞中氧化应激能够激活STAT1[8],可见缺血再灌注后STAT-1的持续激活可能与再灌注损伤有着密切联系[9]。此外,缺血导致的STAT1激活与缺血性脑损伤导致大量细胞因子和生长因子的释放,尤其是IFN-γ在MCAO的缺血组织中大量合成有关[10]。我们的研究同时显示在缺血周围区纹状体内STAT-1同样被持续激活,这与West等[11]报道一致,提示在该区即使没有出现细胞立即死亡,可能也有些细胞进入了程序性死亡的过程中,如果给予及时有潜在的被拯救的可能性。
最近报道,绿茶的一种主要成分绿茶多酚物——表没食子儿茶素没食子酸酯(polyphenolic agent Epigallocatechin-3-gallate,EGCG)是STAT-1磷酸化活化的有效抑制剂。用EGCG和绿茶提取物(green tea extract,GTE)来培养心肌细胞和离体鼠心脏,发现两者可显著减少STAT-1的磷酸化而保护心肌细胞免受I/R诱导的细胞凋亡[12]。那么,在局灶脑缺血的中心区或周围区,这两种物质是否也可以抑制STAT1的酪氨酸或丝氨酸的磷酸化水平而减少脑损伤?这些我们都将继续研究下去。
【】
1 Dell’Albani P,Santangelo R,Torrisi L,et al. Role of the JAK/STAT signal transduction pathway in the regulation of gene expression in CNS. Neurochem Res,2003,28(1):53-64.
2 Liu T,Castro S,Brasier AR,et al. Reactive oxygen species mediate virus-induced STAT activation: role of tyrosine phosphatases. J Biol Chem,2004,279(4):2461-2469.
3 Takagi Y,Harada J,Chiarugi A,et al. STAT1 is activated in neurons after ischemia and contributes to ischemic brain injury. J Cereb Blood Flow Metab,2002,22(11): 1311-1318.
4 Planas AM,Justicia C,Ferrer I. Stat1 in developing and adult rat brain. Induction after transient focal ischemia. Neuroreport,1997,8(6): 1359-1362.
5 Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke,1989,20(1): 84-91.
6 Li H,Zhang Q,Zhang G. Signal transducer and activator of transcription-3 activation is mediated by N-methyl-D-aspartate receptor and L-type voltage-gated Ca2+ channel during cerebral ischemia in rat hippocampus. Neurosci Lett,2003,345 (1): 61-64.
7 White BC,Sullivan JM,DeGracia DJ,et al. Brain ischemia and reperfusion: molecular mechanisms of neuronal injury. J Neurol Sci,2000,179(S 1-2): 1-33.
8 Madamanchi NR,Li S,Patterson C,et al. Thrombin regulates vascular smooth muscle cell growth and heat shock proteins via the JAK-STAT pathway. J Biol Chem,2001,276(22):18915-18924.
9 Chan PH. Reactive oxygen radicals in signaling and damage in the ischemic brain. J Cereb Blood Flow Metab,2001,21(1): 2-14.
10 Li XL,Hassel BA. Involvement of proteasomes in gene induction by interferon and double-stranded RNA. Cytokine,2001,14(5): 247-252.
11 West DA,Valentim LM,Lythgoe MF,et al. MR image-guided investigation of regional signal transducers and activators of transcription-1 activation in a rat model of focal cerebral ischemia. Neuroscience,2004,127(2): 333-339.
12 Townsend PA,Scarabelli TM,Pasini E,et al. Epigallocatechin-3-gallate inhibits STAT-1 activation and protects cardiac myocytes from ischemia reperfusion-induced apoptosis. FASEB J,2004,18(13): 1621-1623.











