厄贝沙坦对糖尿病大鼠肾脏MMP-2/TIMP-2基因表达的影响
来源:岁月联盟
时间:2010-07-12
【关键词】 厄贝沙坦 基质金属蛋白酶-2 组织金属蛋白酶抑制因子-2 糖尿病肾病
Effects of irbesartan on expression of matrix metalloproteinase-2/tissue
【Abstract】 Objective To observe the effects of irbesartan on expression of matrix metalloproteinase-2/tissue inhibitor of metalloproteinase -2 in streptozotocin induced diabetic rats. Methods Male Sprague-Dawley (SD) rats were randomly divided into three groups: normal control rats (group N,n=8), diabetic rats (group DN,n=9) and diabetic rats treated with Irb (group DNI,n=10). Diabetes was induced by injection of STZ intraperitoneally after rats had received uninephroectomy. Renal expression of MMP-2 and TIMP-2 was determined by RT-PCR when all rats were sacrificed at week 8.Results Semi-quantitative assessment of RT-PCR showed that glomerular expression of MMP-2 and TIMP-2 in group DN was significantly increased as compared to that in group N and much lower in group DNI compared to that in group DN.While the ratio of MMP-2/ TIMP-2 was lower in group DN and higher in group DNI.Conclusion The changes of the expression of MMP-2 and TIMP-2 might play a pathogenetic role in diabetic nephropathy. Irb exerted renal protective role to early diabetic nephropathy, possibly through correction the balance of MMP-2/ TIMP-2 which benefited to reduce accumulation of extracelluar matrix(ECM).
【Key words】 irbesartan matrix metalloproteinase-2 tissue inhibitor of metalloproteinase-2 diabetic nephropathy
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的主要并发症和死亡原因之一,为提高糖尿病患者的生活质量及生存率,使得早期防治糖尿病肾病尤为重要。本研究用RT-PCR方法了解基质金属蛋白酶-2(Matrix metalloproteinase-2,MMP-2)和组织金属蛋白酶抑制因子-2(Tissue inhibitor of metalloproteinase-2 ,TIMP-2)在链脲佐菌素(STZ)诱导的糖尿病大鼠肾组织中的表达情况,并探讨新一代的血管紧张素Ⅱ受体拮抗剂(angiotensinII receptor antagonist,AIIRA)厄贝沙坦(irbesartan,Irb)对糖尿病大鼠尿白蛋白排泄、早期肾肥大的改变以及肾脏MMP-2和TIMP-2表达的影响,以阐明其肾保护作用机制,为DN的预防和治疗提供实验理论依据。
1 材料与方法
1.1 糖尿病模型建立和分组 选择SPF级成年雄性SD大鼠,购自院上海实验动物中心[许可证号:SCXK(沪)2002-0010],体重(180±20)g。大鼠右肾切除2周后一次性腹腔注射STZ(Sigma公司, 50mg/kg)诱导糖尿病模型。48h后测血糖,以随机血糖>16.7mmol/L且尿糖强阳性作为糖尿病动物模型建立标准,未达到标准者均淘汰。血糖稳定1周后随机分为糖尿病肾病(DN)组(n=9)和厄贝沙坦治疗组(DNI, Irb 50mg/kg灌胃)(n=10)。另设8只大鼠为正常对照(N)组(n=8),给予等量枸橼酸-枸橼酸钠缓冲液腹腔注射。N组及DN组仅予等量自来水灌胃。实验期间血糖保持在20mmol/L左右。
1.2 一般观察指标和测定方法
1.2.1 生化指标 外周血血糖用微量血糖仪检测;血生化指标及尿肌酐用自动生化分析仪检测;CCr按公式:尿肌酐浓度(mg/ml)×每分尿量(ml)/血肌酐浓度(mg/ml),并用体重校正。
1.2.2 尿白蛋白测定 采用液相免疫沉淀方法。
1.3 病理组织切片染色 采用H.E染色。
1.4 RT-PCR (1)肾组织总RNA的提取;(2)测定RNA浓度、纯度和完整性;(3)引物:MMP-2:5′ GGTTTATTTGGCGGAC 3′;5′ TCAGCAGCCCAGCCAGTC 3′[1]512bp;TIMP-2:5′GGCAAGATGCACATTACC 3′;5′TTGACATCCCTTCCTGGA 3′[2]386bp;β-actin:5′ GATGGTGGGTATGGGTCAGAAGGA 3′;5′ GCTCATTGCCGATAGTGATGACCT 3′[3]632bp;(4)在PCR仪中42℃ 60min,99℃ 5min进行逆转录;(5)扩增:95℃ 7min×1 cycle;95℃ 55sec Tm 56sec 72℃ 1min×36 cycles;72℃ 10min×1 cycle;6 以1.7%的琼脂糖凝胶电泳PCR产物,电压100mV,约40min用Image Master VDS扫描分析仪扫描凝胶图谱。用Total Lab分析软件对PCR条带进行密度扫描分析,目的片段和β-actin的比值作为实验数据。
1.5 统计学方法 所有数据均以x±s表示,采用Prism 3.0统计软件,组间比较采用方差分析或t检验和U检验。P<0.05为差异有显著性。
2 结果
2.1 各组大鼠血糖、体重变化 由表1可知,腹腔注射STZ后,糖尿病大鼠血糖明显上升,体重明显减轻。但是DN组与DNI组大鼠血糖无差异(P>0.05)。
2.2 各组大鼠CCr、24hUalb的改变 由表2可见,8周时DN组CCr较N组明显升高(P<0.01),而DNI组CCr较DN组明显下降(P<0.01),但未恢复至正常水平。DN组大鼠24hUalb 8周时与N组相比明显升高(P<0.01),DNI组与DN组同期相比,24hUalb明显减少(P<0.01),但与N组相比仍增高(P<0.01)。
2.3 各组大鼠肾脏肥大指标的改变 如表1所示,8周时DN组肾重、肾脏肥大指数(肾重/体重×1000)较N组明显增加(P<0.01),DNI组肾重、肾脏肥大指数(肾重/体重×1000)较DN组显著减少(P<0.05或P<0.01),提示肾脏肥大明显受抑制,但与N组比较仍差异有非常显著性(P<0.01)。
2.4 肾组织病改变和定量分析 8周后,正常大鼠肾小球和肾小管间质未见明显的病理改变。糖尿病大鼠肾组织可见肾小球体积明显增大,系膜区增宽,但未见明显的肾小球硬化。病理定量分析结果表明(表1),至8周时DN组肾小球面积和体积较N组明显增加(均为P<0.01),DNI组与DN组比较明显减小(均为P<0.01)。
2.5 肾组织MMP-2和TIMP-2的表达及半定量结果比较 MMP-2和TIMP-2在N组大鼠有微弱表达,DN组大鼠二者的表达较N组明显增加(均为P<0.01),经Irb治疗后的DNI组二者的表达较DN组明显减弱(均为P<0.05)(图1)。但MMP-2/TIMP-2的比值在DN组减少,DNI组升高(均为P<0.05)(见表3)。

图1 8周各组大鼠MMP-2/TIMP-2 RT-PCR结果:N组大鼠有微弱表达,DN组大鼠二者的表达较N组明显增加,经Irb治疗后的DNI组二者的表达较DN组明显减弱。N:正常组;DN:糖尿病组;DNI:Irb治疗组
表1 8周后各组大鼠血糖、体重及肾脏肥大的比较 (x±s)
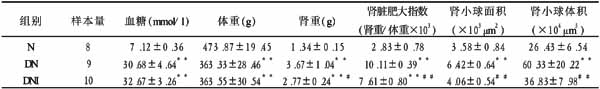
注:**P<0.01与正常组比较;##P<0.01,#P<0.05与糖尿病组比较。N:正常组;DN:糖尿病组;DNI:Irb治疗组
表2 8周后各组大鼠肾功能比较 (x±s)
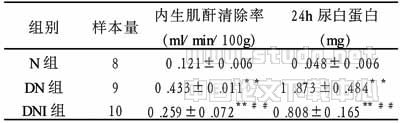
注:**P<0.01与正常组比较;##P<0.01与糖尿病组比较。N:正常组;DN:糖尿病组;DNI:Irb组
表3 8周后各组大鼠肾组织MMP-2和TIMP-2mRNA表达及MMP-2/TIMP-2比值的比较 (x±s)

注:**P<0.01,*P<0.05与正常组比较;#P<0.05与糖尿病组比较。N:正常组;DN:糖尿病组;DNI:Irb治疗组
3 讨论
ECM的过度积聚是肾小球硬化的前奏。ECM是由合成和降解两个代谢过程调节的,两者之间的平衡决定了ECM的积聚和纤维化的进程。ECM合成增加和(或)降解减少,将引起ECM过度积聚,导致器官纤维化。ECM降解蛋白酶主要有两个系统:纤溶酶原激活物(PA)/纤溶酶系统和基质金属蛋白酶系统(MMPs),PA活性受纤溶酶原激活物抑制物PAIs的抑制,金属蛋白酶组织抑制物TIMPs可抑制MMPs的活性[4]。MMPs是一类含有Zn2+,活性依赖Ca2+的结构高度同源的内肽酶的总称,是目前认为最重要的一类降解ECM的蛋白酶类,几乎能降解全部ECM成分。
在本研究中,RT-PCR结果提示8周糖尿病大鼠肾组织MMP-2和TIMP-2 mRNA表达上调,但MMP-2/TIMP-2的比值却是下降的,这可能导致MMP-2活性下降,ECM降解减少,从而促进DN的发生、发展。Mclennan、Wahab和Mason等发现高糖可以使人系膜细胞MMP-2表达增加而MMP-9、MMP-7表达减少,TIMP-1表达增加[5~7]。同样在STZ诱导的糖尿病大鼠肾组织中Mclennan等测定MMP-2 mRNA表达是增高的,而其活性却下降了49%[8]。Wang等人研究发现高糖可以增加小鼠系膜细胞MMP-2 mRNA和活性(仅培养24h)[9]。Reckelhoff等人发现STZ诱导的糖尿病大鼠肾小球MMP活性在糖尿病早期下降75%,在此后的慢性阶段亦持续下降40%~50%。Caenazzo等人在人和小鼠系膜细胞培养中发现高糖可以使MMP-2和TIMP-2mRNA合成减少,而MMP-2/TIMP-2比值降低,使MMP-2活性下降,ECM降解减少,从而有利于ECM沉积,系膜基质扩张[10]。虽然由于各种原因可能导致了不同的实验结果,但是更多的研究,包括本研究提示MMP-2/TIMP-2比例失衡,MMP-2活性下降在DN的发生、发展中起重要作用。
肾脏局部RAS系统的异常可能在DN的发生发展中具有重要作用。AngⅡ是该系统的效应分子。肾脏局部AngⅡ的浓度比血浆中高出1000倍,局部的AngⅡ除可引起血流动力学改变外,尚可直接调控多种血管活性因子、细胞因子、生长因子以及炎症细胞的作用,如ET-1、TGFβ、bFGF、PDGF、TNFα、OPN、VCAM-1、NF-κB等,从而影响肾细胞的生长和基质代谢[11~13],是一种生长因子和促纤维化因子。AngⅡ与特异性受体结合后发挥生理作用。AngⅡ受体主要有AT1、AT2、AT3、AT4四种亚型[14],AT1受体在肾脏表达尤为丰富,机械牵拉能促进表达,AngⅡ参与肾损害的作用主要与此型受体有关。大量临床试验如IRMA-2、RENAAL、IDNT等均已证实Irb可以降低2型糖尿病患者尿蛋白的排泄,延缓肾病进展,使透析或行肾移植时限平均延迟2年[15]。但其确切机制尚不明确。我们的研究亦发现Irb能够降低糖尿病大鼠早期尿白蛋白排泄,降低过高的CCr,改善肾小球的高滤过;同时经Irb治疗的糖尿病大鼠肾脏肥大指数、肾小球面积、体积较糖尿病大鼠明显减小,说明Irb可以抑制早期肾脏肥大;DNI组大鼠MMP-2/TIMP-2的比值升高,达到正常对照组水平,提示Irb可以纠正MMP-2/TIMP-2比例失衡,提高MMP-2活性,加强ECM降解,从而实现肾脏保护功能。
本实验从肾脏ECM降解方面阐述了早期DN的发病机制;证实了Irb,一种新型AⅡRA的肾脏保护作用,并且这种保护作用与MMP-2/TIMP-2密切相关,为DN的早期预防和治疗提供重要理论依据。
【】
1 Morrison JC,Butler GS,Bigg HF,et al. Cellular activation of MMP-2(gelatinase A) by MT2-MMP occurs via a TIMP-2-independent pathway. J Biol Chem,2001,276(50):47402-47410.
2 宛霞,黄湖辉,李劲高.氯沙坦对糖尿病大鼠肾组织TIMP-2mRNA表达的影响.中山医科大学学报,2002,23(3):190-193.
3 Purnelle G,Gerard A,Czajkowski V,et al. Pulsatile secretion of gonadotropin-releasing hormone by rat hypothalamic explants without cell bodies of GnRH neurons corrected. Neuroendocrinology, 1997,66(5): 305-312.
4 李才,张一宁,牛俊奇,等.器官纤维化基础与临床.北京:人民卫生出版社,2003,31-36.
5 Mclennan S,Fisher E,Yue DK,et al. High glucose concentration causes a decrease in mesangium degradation. Diabetes,1994,43:1041-1045.
6 Abdel Wahab N,Mason RM. Modulation of neutral protease expression in human mesangial cells by hyperglycaemic culture. Biochem J,1996,320:777-783.
7 Mclennan S,Yue DK,Turtle JR. Effect of glucose on matrix metalloproteinase activity in mesangial cells. Nephron,1997,79:293-298.
8 Mclennan SV,Kelly DJ,Cox AJ,et al. Decreased matrix degredation in diabetic nephropathy:effects of ACE inhibiton on the expression and activities of matrix metalloproteases. Diabetologia,2002,45(2):268-275.
9 Wang ZJ,Bocchicchio J,Fadly M,et al. Glucose increases 72kDa metalloproteinase activity(Abstract). J Am Soc Nephrol,1994,5:974A.
10 Caenazzo C,Garbisa S,Onisto M,et al. Effect of glucose and heparin on mesangial α1(Ⅳ)COLL and MMP-2/TIMP-2mRNA expression. Nephrol Dial Transplant,1997, 12:443-448.
11 Wolf G, Ziyadeh FN. The role of angiotensin Ⅱ in diabetic nephropathy: emphasis on nonhemodynamic mechanisms. Am J Kidney Dis,1997,29(1):153-163.
12 Wolf G, Neilson EG. Angiotensin Ⅱ as a renal growth factor. J Am Soc Nephrol,1993,3:1531-1540.
13 Egido J. Vasoactive hormones and renal sclerosis. Kidney Int,1996,49:578-597.
14 Messerli FH,Weber MA,Brunner HR. Angiotensin II receptor inhibition. Arch Intern Med,1996,156:1957-1965.
15 Ruilope LM,Segura J. Losartan and other angiotensin II antagonists for nephropathy in type 2 diabetes mellitus:a review of the clinical trial evidence. Clin Ther,2003,25(12):3044-3064.











