肝门部胆管癌的治疗
作者:解英俊,张学文△,赵吉生,姜涛,季德刚,曹宏,张丹
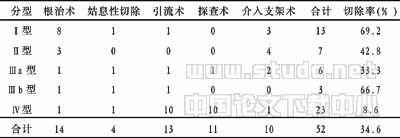
【摘要】 目的 探讨肝门部胆管癌的方法。方法 回顾性分析我院1996~2004年间52例肝门部胆管癌患者的临床病例资料。Ⅰ型癌肿切除率最高,Ⅳ型癌肿切除率最低。结果 本组52例肝门部胆管癌中,围手术期死亡2例,均死于肝肾功能衰竭,余50例中31例术后获得随访,失访19例,随访率为62%。结论 疑似或诊断肝门部胆管癌应早期积极手术探查,争取行根治性切除术;肝门部胆管癌肿瘤切除疗效明显优于其他治疗方式。 表1 分型及术式选择 (例)
表2 术后常见并发症 (例)
|
2.2 肿瘤无法切除者方式选择 术中判定双侧二级以上胆管受侵者;肝动脉、门静脉广泛浸润或同时受侵者,癌肿无法切除,应行引流术。引流目的是解除胆道梗阻,引流胆汁,减轻肝功能损害,控制胆管炎发生,延长生存时间,提高生活质量。引流治疗包括内引流和外引流。本组行内外引流术共13例,其中行右侧肝内胆管-胆囊-空肠吻合术1例,高位胆管插管与空肠搭桥引流术4例,T型管引流2例,U型管引流6例。
外引流优点为术式简单创伤小,还可经引流管行放化疗治疗。但由于丢失大量胆汁,易造成水电解质平衡紊乱,而且引流管易阻塞、移位、脱落,引流管护理困难,容易招致感染,继发胆管炎,影响生活质量。内引流由于保存了胆汁代谢的正常生理途径,效果好于外引流。所以,多数学者主张应尽量选择内引流手术。内引流手术包括胆肠吻合术、搭桥式内引流术、经胆管置入内支架引流术等,其中胆肠Roux-en-Y吻合术最为常用。
各项辅助检查明确提示肝脏广泛转移;双侧二级以上胆管受侵;肝动脉、门静脉广泛浸润或同时受侵;远处转移者或根治术后局部复发再次出现胆道梗阻者,可行PTCD或ENBD引流或采取介入方法经PTCD、ERCP放置支架。其中支架术优点是操作简单有效,符合生理,通过内支架达到内引流目的,并且内支架的放置可采用多种方法,能适用不同病情的病人。支架术缺点主要是可能发生胆泥壳样沉着,或肿瘤向支架内生长,从而导致支架堵塞,常需更换而且造价高。
2.3 术后常见并发症 HBDC患者除有高胆红素血症外,常合并内毒素血症,营养不良、贫血、低蛋白血症、凝血机制障碍、电解质紊乱、免疫功能低下、感染及肝、肾、心血管等重要脏器损害,加上手术创伤大,术后并发症多,严重时直接导致死亡。
2.3.1 腹腔大出血 多发生于合并肝叶切除及术中门静脉损伤者,亦见于胆肠吻合口出血,腹腔引流鲜血>200ml/h,提示腹腔内有活动性出血。急诊手术止血。预防以术中确切缝合止血为主。
2.3.2 胆瘘 为最常见并发症,多发生肝叶切除肝创面胆管处理不当或肝内胆管分别与空肠吻合,因肝内胆管开口众多,有时难以处理妥善,改用胆管成型后与空肠吻合,胆汁瘘发生减少;亦可发生于经肝引流管穿出肝表面处。近来研究发现胆管血供不良是胆瘘发生的重要因素。高位胆管血供主要来自胆囊动脉或肝固有动脉分支,有时也由肝右动脉分支供应,并且沿胆道呈轴向性走行,约60%血流自下向上,约40%血流来自上方,当肿物及肝外胆管切除术后,尤其肝右动脉结扎切除后胆道吻合端血循环将受到影响,造成吻合口愈合不良形成胆瘘。胆管血液循环研究将成为肝胆外科的焦点问题。术中游离胆管时,注意保存胆管两侧和后方的血供,胆管上端断端吻合前应有活跃的动脉性出血。本组2例术后胆瘘,术后1~5天密切观察腹腔引流量及性状,根据腹腔引流液性状,不难诊断。1例保守治疗自愈,1例行引流术治愈。引流充分者多可在2~3周自愈,否则易导致腹腔感染、脓肿,需抗炎、引流治疗。
2.3.3 肝功能衰竭 围手术期死亡常见原因,多见于肝脏储备功能差的患者。本组2例术后出现肝功能衰竭死亡。预防包括结合术前肝功能评测,正确判定手术切除范围,积极进行围手术期保肝治疗,尽可能避免使用对肝肾功能损害大的药物。日本学者提出术前行PTCD,降低血清胆红素,利于肝功能恢复。但多数学者仍对其增加感染并发症,延长治疗时间,导管并发症发生率高等存在顾虑,主张血清总胆红素高于410μmol/L以上时行PTCD,通过4~6周减黄后,再行手术治疗。Makuuchi[11]提出手术前病例施行经皮拟切除侧门静脉栓塞术,待2~3周后对侧肝脏体积增大后才施行手术,可以增加半肝或三叶切除术的安全性。定期复查肝功,观察患者有无黄疸加重、烦躁不安、嗜睡等肝功能衰竭表现。
2.3.4 急性肾功能衰竭 多继发于重度黄疸。常因有效循环血容量不足,交感神经兴奋、肾素血管紧张素系统活动增强、肾前列腺素减少,血栓素A2增加及内毒素血症所致。特征为自发性少尿或无尿、氮质血症、稀释性低钠血症和低尿钠。预防:术中给予20%甘露醇100~250ml,以维持利尿状态;术后24h尿量少于1500ml且血压正常时,可用速尿20mg静推。
2.3.5 应激性溃疡出血 为重症梗阻性黄疸病人术后严重并发症。其发病机制尚未完全明了,一般认为高胆红素血症、高胆盐血症破坏胃黏膜屏障,减少胃黏膜血流有关。同时患者常合并感染、败血症、营养不良等,手术创伤大均可导致胃黏膜低灌注形成黏膜溃疡出血,严重者可出现穿孔。本组2例出现应激性溃疡,经给予止血、抑酸药治疗治愈。预防:术前纠正贫血,补充血容量,抗感染治疗,术后常规应用H2受体拮抗剂,有消化道出血时急检纤维胃镜,确诊同时局部止血。同时改用质子泵抑制剂,一般保守治疗多能治愈。如出血量大,需行手术治疗。
总之,加强围手术期的器官功能的支持,预防和治疗感染应是降低围手术期并发症的主要措施,可减少并发症和死亡率。
本组病例从生存期角度比较各种术式预后,结果显示肿瘤切除组优于手术引流组,t=3.395(r=18,P<0.01),统计学差异有非常显著性;介入支架组优于单纯手术探查组,t=3.03(r=9,P<0.01),统计学差异有非常显著性。文献报道[8,13]肝门部胆管癌根治性切除疗效明显优于姑息性切除,姑息性切除疗效优于单纯引流。因此,疑似或确诊病例,除有明确手术禁忌证外,应积极行手术探查,争取行根治性切除。
本组显示手术引流组生存期与非手术引流组相近,优于单纯手术探查组。因此,对无法手术者,积极行PTCD、ENBD引流或采取介入方法经PTCD、ERCP放置支架,以期延长生命,提高生存质量。
随着扩大根治术临床推广,切除范围大,手术风险大,术后并发症增多,死亡率高[13]。本组术后并发症发生率癌肿切除组明显高于癌肿未切除组,在统计学上差异有极显著性(χ2=7.71229,P<0.01)。2例因肝肾功能衰竭而围手术期死亡。Gerhards[14]报道12例扩大肝切除和血管切除者,围手术期死亡率达到50%(6/12)。均死于术后肝肾功能衰竭。所以,HBDC根治性切除治疗的前景仍然是很严峻的。
【文献】
1 刘宇斌,简志祥,刘子贤,等.肝门部胆管癌的外科治疗.第一军医大学学报,2004,24(12):1401-1403.
2 刘永锋.肝门部胆管癌的治疗现状.实用外科杂志,2000,20(1):28-31.
3 Burke EC, Jarnagin WR, Hochwald SN, et al. Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system. Ann Surg, 1998, 228(3): 385-388.
4 Escartin A, Doyle H, Madariage JR, et al. Hilar and peripheral cholangicarcinomas.Rev Esp En ferm Dig, 1998, 90(8): 580-583.
5 王曙光,韩本立,蔡景修.胆管癌的浸润、转移及外科治疗中的问题.中华实用外科杂志,1997,17(2):116-118.
6 Hemming AW, Reed AI, Fujita Shiro, et al. Surgical Management of Hilar Cholangiocarcinoma. Annals of Surgery. Proceedings of the 116th Annual Meeting of the Southern Surgical Association,2005,241(5):693-702.
7 Ebata, Tomoki, Nagino,et al. Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases. Annals of Surgery, 2003, 238(5): 720-727.
8 Nimura Y, Hayakawa N, Kamiga J, et al. Hepatic segmentectomy with caudate lobe resection for bile duct carcinoma of the hepatic hilus.Wolrd J Surg, 1990, 14: 535-535.
9 Uchiyama, Kazuhisa, Nakai, et al. Indications for extended hepatectomy in the management of stage IV hilar cholangiocarcinoma. Archives of Surgery, 2003, 138(9): 1012-1016.
10 Rea, David J, Munoz-Juarez, et al. Major hepatic resection for hilar cholangiocarcinoma: analysis of 46 patients. Archives of Surgery, 2004, 139(5): 514-525.
11 Makuuchi M, Yamasaki S, Hasegawa H, et al. Preoperative portal embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: a preliminary report. Surgery,1990, 107:521-527.
12 Shinchi H, Takao S, Nishida H, et al.Length and quality of survival following external beam radio therapy combined with expandable metallic stent for unresectable hilar cholangiocarcinoma. J Surg Oncol, 2000,75(2): 89-94.
13 Lang Hauke, Sotiropoulos, Georgios C, et al.Extended hepatectomy for intrahepatic eholangiocellular carcinoma(ICC): when is it worthwhile? Single center experience with 27 resections in 50 patients over a 5-year period. Annals of Surgery, 2005, 241(1): 134-143.
14 Gerhards MF, vanGulik TM, De WitLT, et al. Evaluation of morbidity and mortality after resectionfor hilar cholangiocarcinoma a singl center experience. Surger, 2000, 127(4): 395-398.