TTB口含片质量标准的分析方法与与验证
【关键词】:TTB口含片 因体分散法 反相高效液相色谱法 溶出度 质量标准检测
【论文摘要】:本文主要建立TTB口含片质量标准的分析方法及验证。分析项目包括:鉴别试验、限度检查、含量及其它成份测定,溶出度检查。实验方法:分别采用紫外分光光度法、高效液相法和显色法鉴定,采用转篮法测定溶出度,采用HPLC法测定含量。本文所确立的方法TTB口含片质量控制。
TTB(cifixime)又名世福素,是第一个上市的第三代口服头孢菌素,再其C7位上结合有苯甘氨酸类的基团,从而具备可口服吸收的结构,它具有抗菌谱广、抗菌作用强、有效浓度持续时间长等优点,在各类感染中有较高的疗效。该药物1987年由日本藤泽(fujisawa)公司开发,现已在全球二十多个国家上市,该药品被子列为我国“十五”推荐研究开发的重要头孢菌素品种及国家级化学医药新产品指南[12]
据最近报道,2002年美国氰胺公司和日本藤泽公司的TTB销售额超过1.8亿美元。我国1994年由广州白云山制药总厂在独家生产TTB并经多家的临床验证,治疗效果达到日本同类产品效果,现已在国内逐步推广使用,由于价格较贵,目前市场上占有率并不高。但口服头孢菌素由于服用方便且实惠,因而深受医务人员和患者的欢迎。我国目前口服第三代头孢菌素品种较少,TTB作为一代优秀的头孢菌素类新品种,具有很好的前景[1]
目前我国头孢菌素生产业尚属于阶段,开发TTB新剂型、新工艺不仅有利于产品质量调整,而且可以增加竞争力,再不断开发国内市场的同时,以优质低价的产品参与国际竞争。
一、仪器与试剂
仪器:高效液相色谱仪(Agilent 1100 series),智能药物溶出仪(RCZ-8A,天津大学精密仪器厂),754型紫外分光光度计(上海第三分析仪器厂),SC69-02C水分快速测定仪(上海恒平仪器有限公司),紫外扫描仪(Shimadzu岛津UV-260),天平ARZ140 Adventurer (OHAUS CORP.Florham NJ USA ),微量进样器50μl(上海高鸽工贸有限公司),精密PH计(PHS-3C上海雷磁仪器厂)
试剂:磷酸(85% 武汉市化学试剂厂),盐酸(分析纯,信阳市化学试剂厂)10%四丁基氢氧化铵(分析纯 中国医药(集团)上海化学试剂公司),甲醇(康科德,天津市康科德科技有限公司),纯净水(ICE DEW冰露 武汉可口可乐饮料有限公司),氢氧化钠(分析纯 天津市化学仪器供应站),磷酸二氢甲(分析纯 天津市北方化玻购销中心),Methanol(HPLC grade Fisher Chemalert),Acetonitrile (HPLC grade Burdick&Jackson),TTB(购自广州白云山制药有限公司,批号kw060801)
二、方法与内容
1.性状
本品原料的性状是淡黄色,辅料为白色,制成制剂后为浅黄色片。
2.鉴别
2. 1.紫外分光光度法
参照卫生部部标准(试行)WS-691(X-505)-2002:将片剂研磨成细粉,取适量加磷酸盐缓冲液(PH7.0)制成每1ml约含TTB10μg的溶液,滤过,取续滤液,照分光光度法(中国药典2005年版二部附录IVA)测定,在288nm的波长处有最大吸收。见表1。
2.2显色法
参照卫生总部 标准(试行):将片剂研磨成细粉,取适量加1%碳酸氢钠溶液2ml,振摇数分钟,滤过,取渡液加稀盐酸1ml置冰浴中冷却,加新鲜配置的亚硝酸钠溶液(1→100)ml,放置2min加氨磺酸铵溶液(1→40)ml,摇匀,放置1分钟,再加盐酸N-(1-萘) 乙二胺溶液(1→1000)ml,摇匀,溶液呈紫红色,共检查三批样品,均呈正结果。
3.溶出度方法的试验
参照卫生部部标准(试行)WS-691(X-505)-2002制定TTB口含片的溶出度的检测方法。
3.1溶剂的选择
分别采用磷酸盐缓冲液(PH6.5)(部标WS-691(X-505)-2002)盐酸溶液(参考中国药典)和水各1000ml 为溶剂,转速为每分钟100转,经30分钟时取样滤过,精密量取续滤液5 ml ,用上述溶剂稀释成25ml,另取原料,用上述溶剂配制成10μg/ml的溶液,照分光光度法,在288nm处分别测定吸光度,每片的溶出量,结果见表2。
3.2转速的确定
其它条件不改变,将转速在75转/分,100转/分,120转/分,分别测定溶出度,结果见表3。
3.3溶出曲线的绘制
以磷酸盐缓冲液(PH6.5)1000ml为溶剂,转速100转/分,分别取六片,投入到6个容器中,分别于10、25、35、45、60、75、90分钟取样15ml滤液,滤过,照紫外分光光度法测定,结果见表4-1,图4-2。
3.4片剂辅料的影响
将每片中所含辅料分别投入到容器中,照溶出度方法项下操作,分别在10、20、30、45分钟取样,用紫外分光光度法测定结果,见下表5。说明辅料对主药的测定无干扰。
3.5溶出度实验结果
将TTB口含片分别按照制定的溶出度检验方法进行检查,结果见表6,均符合规定。
4 含量测定(HPLC法)
参照卫生部标准(试行)WS-691(X-505)-2002,将TTB口含片的含量测定采用HPLC法(中国药典2005年版二部附录VD)测定。
4.1色谱条件与系统适用性实验
仪器:Agilent 1100 series G 1310 IsoPumP G1314AVWD;色谱柱:ReliaSilC18-(5um 250*4.6mm);流动相:四丁基氢氧化铵溶液(用1.5mol/l磷酸溶液调节PH值到7.0)- 乙腈(70:30)
检测波长为254nm,TTB峰保留时间为11.045min,分离度为1.892,理论塔板数13446,均符合部颁标准要求。
4.2 辅料的影响
按处方量取空白辅料,置100ml容量瓶中,加磷酸盐缓冲液(PH7.0)并稀释至刻度,摇匀,取0.020ml注入液相色谱仪,观察实验结果得知辅料对主药吸收无干扰。
4.3 回收实验
精密取TTB原料9份(40mg、50mg、60mg各3份),按处方规定加空白辅料,配成供试品溶液,另取同批TTB原料适量,配成对照溶液,分别取0.020ml注入液相色谱仪,记录色谱图,用外标法计算回收率,见表7。
4.4线性实验
精密称取20mgTTB原料药,分别用磷酸盐缓冲液(PH7.0)配成不同浓度的供试品溶液,分别取0.020ml注入液相色谱仪,记录色谱图,结果见表8。
4.5方法的精密度
取TTB原料20mg,置100ml容量瓶中,按处方规定加入空白辅料,配成供试品溶液;另取同批TTB原料适量配成0.120 mg/ml的对照液,分别取0.020ml,连续进样6针,结果见表9。
4.6稳定性实验
取本品细粉,加磷酸盐缓冲液(PH7.0)使溶液并定时稀释成0.020g/ml,于0、1、2、4、6小时分别注入液相色谱仪,见表10,记录峰面积,计算RSD值。
4.7HPLC法测定含量
供试品溶液的制备与测定:取本品10片,精密称定,研细,精密称取TTB适量(约相当于TTB200mg)置100ml量瓶中,加磷酸盐溶液缓冲液(PH7.0)60 ml,振摇使TTB溶解(必要时超声处理使溶解完全),再加磷酸盐缓冲液(PH7.0)稀释至刻度,摇匀,滤过,精密量取续滤液10ml,置100ml容量瓶中加磷酸盐缓冲液(PH7.0)稀释至刻度,摇匀,取0.020ml注入液相色谱仪;记录色谱图。
对照品溶液的制备与测定:精密称定TTB原料药20mg,置100ml容量瓶中,加磷酸盐缓冲液(PH7.0)稀释成每毫升中约含TTB0.020mg的溶液(必要时超声处理使溶解完全),同上测定。
含量测定方法:按外标法以峰面积计算出供试品中TTB的含量。结果见表11。
1.结果与讨论
1.鉴别
表1 TTB口含片紫外分光光度法鉴别
波长 | 280 | 282 | 284 | 286 | 288 | 290 | 292 | 294 | 296 | 298 |
吸光度 | 0.385 | 0.402 | 0.407 | 0.412 | 0.414 | 0.412 | 0.404 | 0.390 | 0.372 | 0.357 |
2.溶出度方法试验
2.1溶剂的选择
表2溶剂的溶出度测定
溶出介质 | 磷酸缓冲液 | 0.1mol/L盐酸溶液 | 水 |
30min | 81.98% | 68.32% | 29.71% |
45min | 94.69% | 92.80% | 35.38% |
从结果来看,采用磷酸盐缓冲液(PH6.5)1000ml为溶剂,在规定的时间内能达到很好的溶出,以0.1mol/L盐酸溶液1000ml为溶剂,溶出度亦能达到药典要求,但较磷酸盐缓冲液稍低,且该法不易定容,故不于采用。以水为溶剂,结果很不理想,不予采纳。从而采用部颁标准规定以磷酸盐缓冲液(PH6.5)为溶出溶剂。
2.2转速的确定
表3 不同转速的溶出度比较
转速 | 75转/分 | 100转/分 | 120转/分 |
30min | 52.91% | 89.19% | 93.71% |
45min | 74.47% | 107.18% | 108.61% |
结论:从上表来看,转速越快,则溶出度越高,但在转速高于100转/分后,影响不明显,从保护仪器的角度考虑,故将转速定为100转/分。
2.3溶出曲线的绘制
表4-1 TTB口含片的溶出曲线
5 | 10 | 25 | 35 | 45 | 60 | 75 | 90 | |
1 | 19.35% | 37.86% | 82.71% | 105.12% | 110.00% | 106.56% | 106.63% | 105.79% |
2 | 16.14% | 30.11% | 63.08% | 82.17% | 96.11% | 106.60% | 107.21% | 105.66% |
3 | 16.18% | 28.27% | 59.29% | 79.46% | 94.77% | 108.16% | 109.06% | 106.04% |
4 | 16.82% | 30.93% | 64.41% | 84.65% | 104.01% | 109.96% | 108.65% | 107.06% |
5 | 17.58% | 31.03% | 66.13% | 85.61% | 98.72% | 108.42% | 107.45% | 105.99% |
6 | 16.31% | 31.08% | 66.03% | 85.64% | 99.11% | 108.02% | 107.12% | 105.26% |
平均值 | 17.06% | 31.55% | 66.94% | 87.11% | 100.45% | 107.95% | 107.69% | 105.97% |
表4-2 TTB片平均溶出曲线
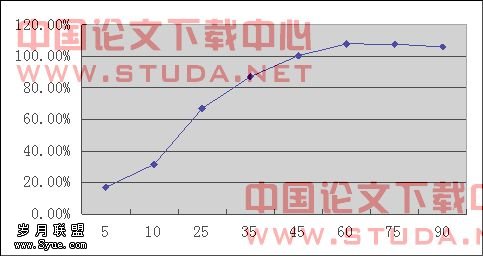
讨论:所有所测六片TTB口含片在90分钟内溶出性能相当好,符合药典规定。
2.4 片剂辅料的试验
表5片剂辅料紫外分光光度测定
时间min | 10 | 20 | 30 | 45 |
A | 0.006 | 0.001 | 0.0016 | 0.0043 |
讨论:由上表可知辅料对主药的测定无干扰。
2.5 溶出度实验结果
表6 TTB片溶出度
溶出度 | 1 | 2 | 3 | 4 | 5 | 6 |
30 | 71.52% | 76.28% | 70.68% | 71.11% | 74.85% | 78.14% |
45 | 91.86% | 98.93% | 88.34% | 95.94% | 91.58% | 93.49% |
讨论:由表6可得出TTB口含片在磷酸缓冲液中,45分钟内溶出率均超过90%,符合药典要求,溶出效果相当理想,故作为质量标准的检测予以采纳。
3含量测定(HPLC法)
3.1回收实验
表7 TTB回收实验(HPLC法)
序号 | 主药量mg | 辅料量mg | 峰面积 | 实测值 | 回收率(%) |
1 | 40.2 | 280.2 | 1834012 | 40.21567 | 100.04% |
2 | 41.6 | 281.3 | 1889756 | 41.4304 | 99.59% |
3 | 40.8 | 279.4 | 1861243 | 40.80907 | 100.02% |
4 | 50.6 | 350.1 | 2398714 | 52.52122 | 103.80% |
5 | 49.8 | 351.4 | 2254682 | 49.38259 | 99.16% |
6 | 51.3 | 349.8 | 2378652 | 52.08405 | 101.53% |
7 | 60.5 | 420.3 | 2798451 | 61.23199 | 101.21% |
8 | 59.4 | 421.7 | 2700152 | 59.08993 | 99.48% |
9 | 61.3 | 419.1 | 2816523 | 61.6258 | 100.53% |
平均 | 100.6% RSD=1.42% | ||||
可知,平均回收率为100.6%,RSD为1.42%,说明本方法准确度高。
3.2 HPLC线性实验
表8 HPLC法线性关系
浓度 | 2 | 10 | 20 | 40 | 80 | 100 | 120 |
峰面积 | 92725.67 | 441411.7 | 916010 | 1824154 | 3627010 | 4554246 | 5535302 |
RSD | 1.12% | 0.11% | 0.81% | 0.11% | 0.13% | 0.55% | 0.09% |
从上表可以说明TTB浓度的2-120μg/ml范围内,浓度与峰面积呈良好的线性关系。
3.3 方法的精密度
表9 HPLC法精密度
对照溶液 | 样品溶液 | ||
对照取药量 | 峰面积 | 对照取药量 | 峰面积 |
49.6mg | 2264659 | 主药:50.6mg 辅料:351.2mg | 2310549 |
2265132 | 2311456 | ||
2263987 | 2310987 | ||
2261549 | 2314982 | ||
2262998 | 2309815 | ||
2264123 | 2310587 | ||
平均峰面积 | RSD=0.06% | 平均峰面积 | RSD=0.08% |
2263741 | 2311396 | ||
3.4稳定性实验
表10 HPLC法的稳定性
时间h | 0 | 1 | 2 | 4 | 6 | RSD |
峰面积 | 1019815 | 1015914 | 1023055 | 1018745 | 1014598 | 0.33% |
3.5 HPLC法
表11 HPLC含量测定的结果
批号 | 1 | 2 | 3 | RSD |
含量 | 95.04% | 96.86% | 98.70% | 1.83% |
结论;通过对样品的考察,含量限度的范围均在标示量的90.00%-110.00%之间,故在质量标准中规定含量限度为标示量的90.00%-110.00%。
【】:
1.张诗海,赵美法. 急需开发的原料药--TTB.精细与专用化学品.2003;12 10-13
2.张永信.头孢菌素的药理特点和选用.上海医药.2003;24(11)495-497
3.孙玉萍.头孢菌素类抗生素的及临床应用中的不良反应,中西医结合杂志, 2002;11(6)578-579
4.谢铂.药学杂志.1998.18(3);250
5.刘宝兰.口服头孢菌素的进展.国外医药--合成药,生化药,制剂分册1998; 18(2)74-78
6.时振洲,刘珏珏,秦,刘树威,头孢菌素进展,医师进修杂志,1997;20(7)381-382
7.邓秋利,头孢菌素类抗生素的临床药理特点与研究进展,广西医学, 1997; 19(2)210-212
8.李祥,马承宜,第三代头孢菌素的合理应用,中国医院感染学杂志, 1997; 7(3)187-189
9.杨威,戴得银,头孢克肟 药学情报通讯.1994;12(2)
10.陈新谦,金有豫,主编,新编药物学,第十四版,北京,人民卫生出版社, 1995;59-60
11.紫外分光光度法测定头孢克肟胶囊的含量,广西医学,2002;24(9);1409-1410











