硫酸氨基葡萄糖对IL-1β诱导人骨关节炎软骨细胞合成IL-1Ⅱ型受体和IL-1Ra的影响
【关键词】 骨性关节炎;硫酸氨基葡萄糖;软骨细胞;IL-1RⅡ
【Abstract】 Objective To study the effects of glucosamine sulfate modulating IL-1β induced expression of IL-1Ra and IL-1RⅡ in human osteoarthritic chondrocytes cultured in vitro. Methods Chondrocytes were harvested from ten OA patients undergone TKR operation and cultured in monolayer cultures. Human recombinant IL-1β(5ng/ml)and GS in different concentrations (2mmol/L,10mmol/L,20mmol/L)were administrated into culture medium of the first or second passage cells. IL-1Ra in the culture medium was evaluated by ELISA,and IL-1RⅡ mRNA expression was examined by RT-PCR.Results Stimulation of human osteoarthritic chondrocytes with IL-1β for 24 hours resulted in significant enhanced production of IL-1Ra (P<0.01) and decreased expression of IL-1RⅡ mRNA (P<0.05). Pretreatment with 2mmol/L or 20 showed a dose-dependent inhibition of IL-1β induced down regulation of IL-1RⅡ mRNA expression (P<0.01) while 0.2 mmol/L GS had no such effect(P>0.05). GS did not affects expression of IL-1Ra,either(P>0.05).Conclusion GS inhibits IL-1β induced down regulation of IL-1RⅡexpression in human osteoarthritic chondrocytes. Our result reveals the possible mechanism of GS as a symptom and structure modifying drug in the treatment of OA.
骨关节炎是老年人最常见的关节疾病,它以软骨结构破坏为特征,最终导致关节功能障碍。致炎因子IL-1β和它作用于软骨细胞和滑膜细胞产生的其他炎性介质,干预了细胞外基质的转化,加速了软骨基质的降解,诱发软骨细胞凋亡[1],被认为是骨 关节炎中诱发和维持软骨损坏的关键因子[2]。
IL-1β的炎症效应要通过细胞浆内IL-1Ⅰ型受体来介导。IL-1Ⅱ型受体虽然也能与IL-1结合,但作为被裁切过的蛋白,它不能产生信号;白细胞介素1受体拮抗物(IL-1Ra)能与Ⅰ型受体特异结合,但没有类白细胞介素1的活性。因此,调节IL-1Ra 和IL-1Ⅱ型受体的合成就成为阻断IL-1的炎症效应靶标之一[3]。
氨基葡萄糖(硫酸或盐酸)(glucosamine sulfate or chloride,GS)是骨性关节炎的常用药,它具有保护软骨的特性,并被认为能修复损伤的软骨。但就目前为止,它在体内、外作用机制均不详。本研究拟通过观察硫酸氨基葡萄糖是否影响IL-1β诱导人骨关节炎软骨细胞合成IL-1Ⅱ型受体和IL-1Ra来探讨GS的作用机制。
1 材料与方法
1.1 材料 3-硫酸氨基葡萄糖,购自Sigma公司。胰蛋白酶、Ⅳ型胶原酶、DMEM培养基、胎牛血清和Trizol Reagent购自Gibco公司。重组人IL-1beta、反转录试剂盒A3500购自 Promega公司。IL-1Ra ELISA试剂盒购自R&D公司。PCR引物由北京赛百盛生物工程公司合成。CO2培养箱,丹麦Heto。酶标仪,美国BIO-RAD。PCR仪,美国Perkin Elmer,GeneAmp9600,基因测定仪、凝胶成像系统和机图像分析系统,美国Pharmacia Biotach。电泳槽,美国Bio-Rad。
1.2 软骨细胞培养 10例原发性骨关节炎住院患者(平均年龄67.3岁),行全膝关节置换术切割下来的股骨髁和胫骨平台标本,在预冷的无菌PBS液中将软骨修剪成0.1mm3大小,0.25%的胰蛋白溶液37℃水浴中孵育30min,离心弃上清后加入0.2%胶原酶溶液,37℃恒温摇床中孵育6h以上。应用DMEM培养液冲洗收获的细胞3次,计数,以2×105/ml的细胞密度接种于25cm2培养瓶中,加入含20% FCS的DMEM 5ml,放入37℃含5%的CO2的细胞培养箱中培养。
1.3 实验分组和给药方法 取培养的第二代细胞按5×105/ml的密度接种在25cm2培养瓶或六孔板中,随机分组,细胞生长至80%汇合时更换培养液为不含FCS的DMEM,让细胞饥饿过夜,然后同时加入IL-1β(5ng/ml)和不同浓度的GS(2mmol/L,10mmol/L,20mmol/L)作用24h,离心,重复取上清后冷冻(-70℃)备用(检测PGE2),细胞用以提取RNA或裂解蛋白。
1.4 ELISA法检测软骨细胞上清中IL-1Ra含量 按试剂盒要求操作,每孔各加入待测细胞上清液200μl,在450nm处测吸光度(OD)值,在半对数纸上作图,画出标准曲线。根据样品OD值在该曲线图上查出相应人IL-1Ra含量。
1.5 RT-PCR法检测IL-1RⅡ mRNA的表达水平 Trizol法提取细胞总RNA。取总RNA 2μg逆转录。PCR反应条件为:94℃预变性5min,然后95℃,45s;55℃,45s;72℃,90s,β-actin(上游引物 5′-GTGGGGCGCCCCAGGCACCA-3′,下游引物5′-CTCCTTAATGTCACGCACGATTTC-3′)进行20个循环,IL-1RⅡ mRNA (上游引物5′-CCAGGAGAAGAAGAGACACGGATG-3′,下游引物5′-CAGGACACAGCGGTAATAGCCAGC-3′)进行30个循环,72℃延伸5min。图像分析:取5μl PCR产物,2%琼脂糖凝胶电泳。目的条带的吸光度V=平均吸光度值×条带面积,IL-1RⅡ的表达强度Rv值=VIL-1RⅡ/Vactin。
1.6 统计学处理 应用SPSS10.0统计学分析软件,计量资料结果以均数±标准差(x±s)表示,多组数据间比较应用one-way ANOVA和Student-Newman-Keuls q检验,P<0.05为差异具有显著性。
2 结果
2.1 GS对软骨细胞合成IL-1Ra的影响 如表1所示,与对照相比,IL-1β刺激软骨细胞合成IL-1Ra增加,其差异具有非常显著性(P<0.01)。0.2mmol/L、2mmol/L和20mmol/L的GS对IL-1β刺激软骨细胞合成IL-1Ra均无影响(P>0.05)。
表1 GS对人骨性关节炎软骨细胞合成IL-1Ra的影响
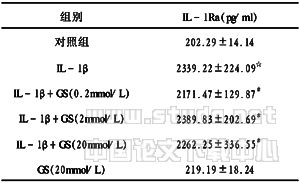
注:n=10,IL-1Ra以均数±标准差表示,与对照组比较,☆P<0.01;与IL-1β组比较,#P>0.05
2.2 GS对软骨细胞中IL-1RⅡ mRNA表达的影响 如表2和图1所示,在人骨性关节炎软骨细胞中,IL-1RⅡ mRNA呈低水平表达。与对照相比,IL-1β刺激软骨细胞表达IL-1RⅡ mRNA下降,差异具有显著性(P<0.05)。2mmol/L和20mmol/L的GS均能抑制IL-1β刺激软骨细胞表达IL-1RⅡ mRNA下调(P<0.01),而且这种修饰以浓度依赖的方式起作用(p<0.01)。而0.2mmol/L的GS则不能影响IL-1β下调IL-1RⅡ mRNA的表达(P>0.05)。但单独使用20mmol/L的GS对软骨细胞表达IL-1RⅡmRNA无影响(P>0.05)。
表2 GS对人骨性关节炎软骨细胞中IL-1RⅡ mRNA表达的影响
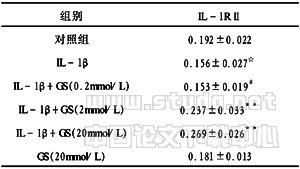
注:n=10,IL-1RⅡ mRNA的Rv值以均数±标准差表示,与对照组比较,☆P>0.05;与IL-1β组比较,#P>0.05;*P<0.05;**P<0.01
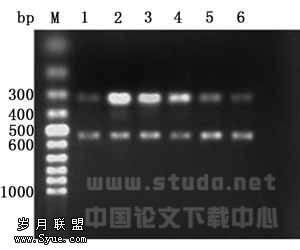
图1 GS对IL-1β诱导的人骨关节炎
软骨细胞中COX-2 mRNA表达的影响Fig1 RT-PCR showed the effect of GS on IL-1β-induced expression of COX-2 mRNA (305bp) in HOC(control:β-actin,539bp): Lane1 control; Lane2 IL-1β; Lane3 IL-1β+GS(0.2mmol/l); Lane4 IL-1β+GS(2mmol/l); Lane5 IL-1β+GS(20mmol/l); Lane6 GS(20mmol/l)
3 讨论
与类风湿性关节炎相比,骨性关节炎被认为是一个相对的非炎症疾病,即骨性关节炎累及的软骨并未显示出红、肿、热、痛的标准炎症表现。然而,最近的研究表明,体外致炎基因(包括NO合成酶、COX-2、IL-1、TNF、IL-6和IL-8等)的超诱导作用导致炎性介质自发分泌,对软骨细胞的功能有破坏作用[4,5]。这种被称为分子炎症的反应,主要依赖于IL-1β的自分泌,它诱导和维系着软骨细胞稳态、软骨基质合成的失平衡状态。
作为造成关节损坏的主要致炎因子,IL-1在骨性关节炎和类风湿性关节炎滑液中浓度均升高,且在骨性关节炎软骨中高水平表达[6]。与正常组织相比,骨性关节炎软骨中IL-1β转化酶表达增加,骨性关节炎软骨细胞表达IL-1受体增加而且对IL-1的作用更敏感[7]。IL-1通过诱导软骨细胞大量基因表达而大大改变了关节生理和软骨代谢。抗IL-1在实验动物模型中已证实有效避免了软骨和骨的损耗,这表明了它在骨性关节炎发病机制中的关键作用[8]。目前,抑制致炎因子IL-1的合成与活性,已成为缓解骨性关节炎的炎症和软骨降解的靶向之一。
体内有两种白细胞介素1的天然拮抗剂:白细胞介素1受体拮抗物(Interleukin-1 Receptor Antagonist,IL-1Ra)和白细胞介素1Ⅱ型受体(Interleukin-1 Receptor Type Ⅱ,IL-1RⅡ)。IL-1Ra能与IL-1受体特异结合,当它与滑膜细胞或软骨细胞的IL-1R结合时,就抑制了IL-1诱导滑膜细胞或软骨细胞分泌前列腺素PGE2和组织降解酶类[9]。界有两种IL-1的受体,IL-1的炎症效应要通过细胞浆内IL-1RⅠ型受体来介导。IL-1RⅡ虽然也能与IL-1结合,但作为被裁切过的蛋白,缺乏胞浆活性域,不能产生生物反应信号[9,10]。通过捕捉IL-1,IL-1RⅡ就能调节IL-1的浓度和效应,这种特性使得IL-1RⅡ成为阻断IL-1的信号传导通路的靶向之一[11]。
本研究中,IL-1β能够诱导人骨性关节炎软骨细胞合成IL-1 Ra增加(P<0.05),表明IL-1Ra的活性与疾病的活动度正相关,这与报道血浆中IL-1Ra浓度与关节炎病损指数成正比的结论一致[11]。加入GS后,IL-1Ra的产生量没有变化(P>0.05),表明GS不能修饰软骨细胞合成IL-1Ra。
Jouvene等[11]报道骨性关节炎的伴随着IL-1RⅡ合成下降,而且它在破坏性关节炎患者的体内水平低于非破坏性关节炎体内。我们也发现,与正常对照相比,加入IL-1β后,人骨性关节炎软骨细胞合成IL-1RⅡmRNA减少(P<0.05)。鉴于骨关节炎软骨内IL-1的mRNA和IL-1上调、IL-1RⅡmRNA下调,说明低浓度的IL-1β在一个骨关节炎长期病程中起着加重炎症、破坏软骨代谢稳态的作用。
我们的研究表明,在IL-1β存在的前提下,氨基葡萄糖能够上调人骨性关节炎软骨细胞IL-1RⅡmRNA的表达,增加IL-1RⅡ的合成量,减少IL-1β与IL-RⅠ的结合,从而抑制IL-1与靶细胞的结合,调节其生物效应。基因功能分析表明内源性可溶性的Il-1RⅡ(sIl-1RⅡ)可以削弱IL-1β的以下作用:对软骨细胞蛋白多糖合成的抑制,诱导软骨细胞和滑膜细胞合成PGE2、NO,以及分泌基质金属蛋白酶[10]。因此,我们认为GS上调IL-1β诱导的人骨性关节炎软骨细胞合成IL-1RⅡmRNA是GS拮抗IL-1β的致炎效应从而缓解软骨降解具有软骨保护的机制之一。
4 结论
硫酸氨基葡萄糖能够拮抗IL-1β对人骨关节炎细胞合成IL-1RⅡ的向下调节,但不影响IL-1Ra的表达;这可能是硫酸氨基葡萄糖保护软骨的机制之一。
【文献】
1 Blanco FJ,Ochs RL. Chondrocyte apoptosis induced by nitric oxide. Am J Pathol,1995,146:75-85.
2 Karaan PM,Berg WB. Anabolic and destructive mediators in osteoarthritis. Curr Opin Clin Nutr Metab Care,2000,3:205-211.
3 Jouvenne P,Vannier E,Dinarello C,et al. Elevated levels of soluble interleukin-1 receptor type Ⅱ and Interleukin-1 receptor antagonist in patients with chronic arthritis: correlations with markers of inflammation and joint destruction. Arthritis Rheum,1998,41:1083-1089.
4 Pincus T. Clinical evidence for osteoarthitis as an inflammatory disease. Curr Rheumatol Rep,2001,3:524-534.
5 Abramson SB,Attur M,Amin AR,et al. Nitric oxide and inglammatory mediators in the perpetuation of osteoarthritis. Curr Rheumatol Rep,2001,3:535-541.
6 Karaan PM,Berg WB. Anabolic and destructive mediators in osteoarthritis. Curr Opin Clin Nutr Metab Care,2000,3:205-211.
7 Blanco FJ,Ochs RL. Chondrocyte apoptosis induced by nitric oxide. Am J Pathol,1995,146:75-85.
8 Tetlow LC,Adlam DJ,Woolley DE. Matrix metalloproteinase and proinflammatory cytokine production by chondrocytes of human osteoarthritic cartilage. Arthritis Rheum,2001,44: 585-594.
9 Colotta F,Dowe SK,Sim JE,et al. The type Ⅱ decoy receptor: a novel regulatory pathway for interleukin 1. Immunol Today,1994,15:562-566.
10 Attur MG,Dave M,Cipolletta C,et al. Reversal of autocrine and paracrine effects of interleukin 1 in human arthritis by type Ⅱ decoy receptor. J Biol Chem,2000,275:40307-40315.
11 Jouvenne P,Vannier E,Dinarello C,et al. Elevated levels of soluble interleukin-1 receptor type Ⅱ and Interleukin-1 receptor antagonist in patients with chronic arthritis: correlations with markers of inflammation and joint destruction. Arthritis Rheum,1998,41:1083-1089.











