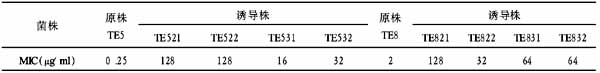
应用 mRNA 差异显示技术克隆常见舌苔相关基因
作者:秦鉴 吴正治 吴国珍 刘红健
【摘要】 目的:筛选、克隆常见舌苔厚度变化的相关基因。方法:利用荧光差异显示技术(FDD),选择厚腻苔、正常薄白苔、病理薄白苔、光剥苔各 10 例,提取其舌苔组织与正常人薄白苔组织中 mRNA,通过电泳找到 mRNA 表达的差异。获得的差异表达 cDNA 片段经 Notthern 印迹证实后进行克隆和测序,分析其来源。结果:发现 45 条差异表达 cDNA 片断(38 条证实为阳性),其中 5 条与人类 98% 以上同源,皆与细胞凋亡有关。结论:舌苔厚度变化与促进和抑制舌苔上皮细胞的凋亡基因有密切关系。
【关键词】 舌苔;差异显示;基因
在中医的四诊中,舌诊以其客观、明了、直接,被历代医家所重视。事实上,在中医临床辨证、立法、遣方、用药以及判断疾病转归、估计病情预后等方面,舌诊发挥着重要的作用[1]。目前,对舌苔形成原理的研究已逐渐深入到亚细胞水平和分子层次[2-4]。传统中医理论认为,舌苔的形成是胃气上蒸于舌面的结果,这种阐释过于抽象、感性和简单。随着科技水平的迅猛,研究中医舌诊中的分子生物学事件已经是人们深入研究中医疾病发生发展机理的必然途径。本研究拟采用先进、简便、成熟的差异显示逆转录聚合酶链反应(DDRT-PCR)法,从相关基因层次探讨常见舌苔发生、发展、变化的机制,探寻其分子生物学基础,丰富舌苔诊断的内容,全面认识舌苔产生的本质、完善中医舌苔理论、指导临床的诊断、促进中医诊断的客观化、定量化、规范化。
1 对象与方法
1.1 标本来源
病理舌苔受检者均系中山大学附属第一门诊及住院病人,病种不限,但注意各组病种分布的平衡;正常组选择无全身各系统器质性病变,并排除近月内舌、口、鼻、咽等局部病变,舌质淡红、舌苔白而润者。《中医诊断学》舌诊标准辨舌苔[5],分为 4 组:正常薄白苔组 10 例,其中男 6 例,女 4 例,年龄 33~52 岁;病理薄苔组 10 例,男 4 例,女 6 例,年龄 38~55 岁;厚苔组 10 例,男 7 例,女 3 例,年龄 46~63 岁;剥苔组 10 例,男 5 例,女 5 例,年龄 45~67 岁。经统计学分析,各组性别、年龄分布无显著性差异。80 例进行临床验证: 正常薄白苔组 20 例,男 10 例,女 10 例,年龄 38~55 岁; 病理薄苔组 20 例,男 11 例,女 19 例,年龄 43~56 岁; 厚苔组 20 例,男 7 例,女 13 例,年龄 36~58 岁; 剥苔组 20 例,男 9 例,女 11 例,年龄 46~61 岁。两次研究对象组间性别、年龄分别比较,无显著差异(P > 0.05)。
每个观察对象用经高温高压消毒的丝瓜络用力刮取舌背中部(花剥苔者取无舌苔覆盖部位)舌苔,装于有预冷生理盐水(含 0.1% DEPC)的 10 mL 具塞离心管中,洗涤、涂片后-70℃密闭保存备用。
1.2 总 RNA 的抽提
取冷藏标本 1 mL Trizol 试剂(美国 GIBCOBRL 公司)中快速电动匀浆,按厂家提供说明抽提组织总 RNA。琼脂糖凝胶电泳检验 RNA 质量,紫外分光光度仪测定浓度及纯度,总 RNA 的 A260/A280 比值在 19~20 之间。
1.3 荧光差异显示
荧光差异显示试剂盒(mRNA profile Kit、fluoro DD Kit 购自美国 Beckman 公司)。
1.3.1 逆转录反应 将取四组样品的总 RNA,稀释至 0.5 g/ L,取 2 L RNA,加 2 L 2 mol/L 的 3′锚式引物,70℃温育 5 min,在冰上快速冷却。加入 2 L l 250 mol/L dNTP,2 L 100 mmol/LDTT,4 L 5×逆转录缓冲液,7.8 L 无 RNA 酶水,0.2 L 200 U/ L 逆转录酶(美国 GIBCOBRL 公司),42℃温育 5 min,50℃温育 50 min。72℃温育 15 min 灭活逆转录酶,-20℃保存备用。
1.3.2 PCR 反应 0.95 L 水,1 L 10×PCR 缓冲液,1.5 L 25 mmol/L MgCl 2,2 L 250 mol/L dNTP,1.75 L 2 mol/L 5′随机引物,0.7 L 5 mol/L 荧光素标记的 3′锚式引物,2 L 逆转录产物,0.1 L 5 U/ L Taq 酶(GIBCOBRL),在 PCR 仪上进行如下反应:95℃ 2 min;94℃ 30 s,50℃ 40 s,72℃ 2 min,共 4 个循环;94℃ 30 s,60℃ 40 s,72℃ 2 min,共 30 个循环;72℃ 延伸 7 min;保存在 4℃。PCR 产物上样于 5.6% 的聚丙烯酰胺凝胶,在Genomyx LR 电泳仪上进行垂直高压电泳 5 h。电泳结束后 50℃干胶 15 min,然后在在 Genomyx SC 荧光图像扫描仪下扫描图像,比较、确定有差异的 cDNA 条带。
1.4 差异条带的回收及再扩增
利用方格图定位,切取含有差异 cDNA 条带的干胶条,浸于 50 L TE 溶液中捣碎,37℃孵育 1 h。取其中的 4 L 用通用引物 M13 和 T7 进行再扩增。二次 PCR 反应体系为 189 L 水,4 L 10×PCR 缓冲液,15 L 25 mmol/L MgCl2,32 L 250 mol/L dNTP,各 4 L 2 mol/L M13 和 T7 引物,4 L 凝胶洗脱液。反应条件同第 1 次 PCR 扩增。
1.5 Northern 印迹法
将 2 次扩增的 cDNA 纯化后用 DIG 标记,制成探针。取约 20 g 总 RNA 上样于 10% 乙二醛变性琼脂糖凝胶,3~4 V/cm 电压下电泳 3 h 后用毛细管法将 RNA 转移到硝酸纤维素膜上,与含有 DIG 标记cDNA 探针的杂交液 50℃杂交 20 h。经漂洗、固定、显色后拍照保存。
1.6 差异 cDNA 片断的克隆和序列测定
取 3 L 经过杂交证实的差异表达 cDNA 片断的 2 次扩增产物,加入 5 L 2×连接缓冲液,1 L pGEM Teasy 载体(美国 Promega 公司),1 L T4 连接酶(美国 Promega 公司),4℃连接过夜,转化用大肠杆菌(Escherichia coli)DH5a 制备的感受态细菌,经过蓝白斑筛选,挑取白色菌落振荡培养,提取质粒 DNA 用 Eco RⅠ酶切鉴定,用 SP6 引物测序。
1.7 选择 80 例研究对象,分别运用 RT-PCR法、斑点杂交法,对目标片断进行临床验证。
2 结 果
2.1 差异 cDNA 条带的确定
用 Trizol 试剂提取了高质量的组织总 RNA,经无 RNA 酶的 DNA 酶Ⅰ处理并纯化后进行琼脂糖凝胶电泳,见 18 S、28 S 条带整齐,亮度比例正常,分光光度仪检测 260/280≥2.0,这说明总 RNA 没有降解。
2.2 荧光差异显示
运用差异显示成像系统扫描变性凝胶,分别显示相同锚定引物各组间差异条带,可比较组间条带的有无、强弱,代表了其差异性。发现 45 条差异表达 cDNA 片断,分别编号。
2.3 Northern 印迹阳性验证
用回收后再扩增的差异 cDNA 片断作探针,与各组各 10 例标本的组织总 RNA 杂交。在不同程度上存在较为明显杂交信号的差异片断有 38 个。
2.4 测序及同源性分析
用 Eco RⅠ对上述 38 个差异片断的 TA 克隆进行酶切鉴定后,阳性克隆送基因公司测序,序列结果用 BLASTN 软件与 GeneBank 中的数据进行比较,选出与人类基因同源 98% 以上的基因有 5 条,差异片断编号分别为 5 号、15 号、21 号、24 号、30 号。5 号片断与凋亡基因 fas 有 99% 的同源,15 号片断与抗凋亡基因 bcl-2 100% 同源,21 号基因与生长因子 TGF -β3 同源 100%,24 号片断和 30 号片断分别与凋亡基因 bax、Caspase-3 有 99% 的同源。
2.5 临床验证
运用 RT-PCR 法、斑点杂交法,对 5 号、15 号、21 号、24 号、30 号片断进行临床验证。结果显示,15 号表达从强到弱的次序分别是厚腻苔组、病理或正常薄白苔组、花剥苔组,5 号、21 号、24 号、30 号表达从强到弱的次序与上述正好相反,分别是花剥苔组、正常或病理薄白苔组、厚腻苔组。
3 讨论
3.1 差异显示基因筛选、克隆方法
舌苔的形成和发生的各种病理变化,除外在原因外,必有其内在的分子层次原因。这些原因变化可以是在器官、组织或细胞水平,但根据分子生物学理论,这种内在的原因最终将追溯到基因层次,即基因的转录、表达和调控。正常的生理过程和病理变化,不管是单基因控制的还是由多基因控制的,最终都是通过基因表达的质或量的差异而实现。这种差异可能源于基因特定的表达调控改变,也可能源于结构上的异常。人类大约有 3 万余个不同基因,而在一种特定的细胞特定的时期中只有部分基因得到表达。正是由于基因的差异表达,决定了所有的生命过程,也决定了舌苔的各种变化。机体发生的各种病理变化,通过各种途径影响舌粘膜上皮细胞内某些基因的转录和表达,有些基因转录、表达增多,有些基因转录、表达减少,有的基因转录、表达停止,有的正常情况下不转录、表达的基因被激活,等等,使上皮细胞的生长、代谢、增殖、化生、退化、角化等各方面的生物学行为发生改变,在临床表现出各种舌苔。可以通过差异显示可以将病理舌苔与正常舌苔的基因转录差别加以甄别、测定、分析。
3.2 舌苔厚薄相关基因分析
本研究中,发现与凋亡相关的基因,其中有促进细胞凋亡的,也有抑制细胞凋亡。
Bcl-2(B-细胞淋巴瘤/白血病-2)基因是一种癌基因,表达产物为由 239 个氨基酸残基(小鼠为236 个氨基酸残基)组成的 25 KD 的膜蛋白,它可抑制或阻断许多因素引起的细胞凋亡[6,7]。
细胞凋亡过程中的主要生物学事件包括细胞皱缩、膜空泡化、核凝聚、DNA 裂解及凋亡小体形成等诸环节均与 Caspase 激活有关。细胞内有 70 余种蛋白是 Caspase 的底物[8,9]。上皮细胞凋亡的调控涉及到许多基因的表达,其中 bax 基因起促进凋亡的作用[10]。bax 也是 Bcl-2 基因家族成员之一,但其生物学作用是拮抗 Bcl-2。bax 与 Bcl-2 各自可形成同源二聚体,也可相互作用为异二聚体。在哺乳动物细胞内,TGF -β3 存在三种同源异构体,即 TGF -β1、β2 和β3,在许多方面它们具有类似的生物学活性,但 TGF -β3 对角质形成细胞的抑制作用比TGF -β1 和 TGF -β2 更强[11]。fas 基因也是起促进凋亡的作用。
在正常表皮中,上皮角质形成细胞通过调节其增殖、分化、凋亡的过程来维持表皮结构的动态平衡[12]。舌苔的厚度与舌上皮细胞的增殖、分化及凋亡之间的平衡密切相关。当舌上皮细胞增殖与分化、凋亡处于相对平衡状态时,舌苔表现为薄苔。而当细胞增殖占优势,细胞凋亡和分化相对占劣势时,舌上皮细胞增多,舌苔即变厚;反之则出现剥苔。
我们发现,与正常薄苔比较,剥苔 bax、Caspase-3、fas、TGF -β3 基因过度表达,Bcl-2 基因表达减少;厚苔 Bcl-2 基因表达水平明显较高,而 bax、Caspase-3、fas、TGF -β3 基因表达水平过少。结果提示,bax、Caspase-3、fas、TGF -β3、Bcl-2 基因表达水平以及它们之间的相互作用的变化可能是影响舌苔上皮细胞凋亡并导致舌苔厚度变化的重要原因。
【】
〔1〕 李乃民. 舌诊大全〔M〕. 广州:学苑出版社, 1994. 5452
〔2〕 吴正治. 舌苔原理研究〔M〕. 广州:中山大学出版社, 1998. 93
〔3〕 吴正治, 郭振球, 李新华, 等. 7种常见舌苔的细胞化学计量诊断研究〔J〕. 北京中医药大学学报, 1996, 19(3):575
〔4〕 吴正治, 李明, 陈光, 等. 常见舌苔舌上皮细胞凋亡与bax、bcl-2基因表达关系的研究〔J〕. 中国中医药科技, 2004, 11(4):193
〔5〕 朱文锋. 中医诊断学〔M〕. 上海:上海技术出版社, 1998. 427
〔6〕 Garcia I, Martinou I, Tsujimoto Y, et al. Prevention of programmed cell death of sympathetic neurons by the bcl-2 proto-oncogene〔J〕. Science, 1992, 258:302
〔7〕 Sentman CL, Shutter JR, Hockenbery D, et al. Bcl-2 inhibits multiple forms of apoptosis but not negative selection in thymocyte〔J〕. Cell, 1991, 67:879
〔8〕 Green DR. Apoptotic pathway:The roads to ruin〔J〕. Cell, 1998, 94:695-698
〔9〕 Evan G and Littlewood T. A matter of life and cell death 〔J〕. Science, 1998, 281:1317-1326
〔10〕Teraki Y, Shiohara T. Apoptosis and the skin〔J〕. Eur J Dermatol, 1999, 9(5):413
〔11〕Shah M, Foreman DM, Ferguson MWJ. Neutralisation of TGF-β1 and TGF-β2 or exogenous addition of TGF-β3 to cutaneous rat wounds reduces scarring〔J〕. J Cell Sci. 1995, 108:985
〔12〕Takahashi H, Aoki N, Nakamure S, et al. Cornified cell envelope fotmation is distint from apoptosis in eermal keratinocytes〔J〕. J Dermatol Sci 2000, 23(3):1619