川芎嗪抗实验性肝纤维化组织中TGF-β1阳性面积率表达的比较
作者:吴建红 陕 光 张端莲 叶庆斌 郑承庆 熊烈
【关键词】 川芎嗪
摘 要: 目的: 观察川芎嗪对大鼠实验性肝纤维化作用的效果。方法: 采用四氯化碳(CCL 4 )诱导大鼠肝纤维化模型,将 实验动物随机分为正常对照组(N)5只、肝纤维化模型组(H)20只、川芎嗪治疗组(TMP)20只,除正常对照组以外其它两组均给予 40% 四氯化碳(CCL 4 )花生油溶液0.3ml/100g腹腔注射,每周2次,共6周。川芎嗪组于肝纤维化模型建立后给予盐酸川芎嗪 (TMP)60mg/ kg 经口灌胃,1次/d,连续治疗60天;其余两组同时给予同等剂量的生理盐水。于60天后分别处死各组大鼠。用免疫 组织化学方法染色观察肝组织中转化生长因子β1(TGF-β1)表达的变化,并利用机图像分析技术测量正常对照组、肝纤维化模 型组及川芎嗪治疗组TGF-β1表达的平均阳性面积。结果:免疫组织化学S-P法染色显示TMP能明显抑制肝组织中TGF-β1水平的 表达, TGF-β1在川芎嗪治疗组中的表达明显低于肝纤维化模型组, TGF-β1在川芎嗪治疗组与肝纤维化模型组之间有显著性差异( P <0.01); TGF-β1在川芎嗪治疗组与正常对照组中呈高表达, TGF-β1在川芎嗪治疗组与正常对照组之间差异无显著性( P >0.05)。 结论: 川芎嗪对四氯化碳(CCL 4 )诱导的大鼠实验性肝纤维化有明显的保护和治疗作用。
关键词: 川芎嗪; 肝纤维化; 转化生长因子β1(TGF-β1); 免疫组织化学; 阳性面积
肝脏由肝的实质细胞和非实质细胞构成, 实质细胞系指 肝细胞(HC) , 而非实质细胞包括窦内皮细胞(SEC)、枯否氏 细胞(KC)、肝星状细胞(HSC) 和陷窝细胞(pit cell) , 这些细 胞经研究表明均以不同方式参与肝纤维化(LF)的形成。 肝纤维化是各种慢性肝病至肝硬化的必由之路,部 分甚至发展为肝癌,目前仍然缺乏有效的抗纤维化的治疗。 寻找有效的抗肝纤维化的药物是目前临床研究的一个热点。 川芎嗪是中药川芎的有效成分,对肝细胞具有保护作用,具有 一定的阻抑肝纤维化作用。本研究用免疫组织化学方法染色 观察肝组织中转化生长因子β1(TGF-β1)表达的变化,并利用 计算机图像分析技术测量正常对照组、肝纤维化模型组及川 芎嗪治疗组TGF-β1表达的平均阳性面积,观察川芎嗪对大鼠 实验性肝纤维化作用的治疗效果,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 试验动物 Wister雄性大鼠(SPF级)45只,体重280 ~360g, 由武汉大学医学院动物试验中心提供。食用标准大 鼠饲料, 饮自来水, 室温22℃。
1.1.2 大鼠肝纤维化模型制备及药物应用 将40只大鼠随 机分成2组,川芎嗪组20只,对照组20只。另设正常对照组 5只。除正常组以外其它两组均给予40%四氯化碳(CCL 4 ) 花生油溶液0.3ml/100g腹腔注射,每周2次,共6周。川芎嗪 组于肝纤维化模型建立后给予盐酸川芎嗪(TMP)60mg/ kg 经 口灌胃,1次/d,连续治疗60天;其余两组同时给予同等剂量 的生理盐水。于60天后分别处死各组大鼠,取其新鲜肝脏方 叶小块组织,10% 中性甲醛中固定,常规HE染色观察肝脏组 织学改变。
1.2 试剂与仪器
1.2.1 主要试剂 ① 浓缩型鼠抗人TGF-β1多克隆抗体(北 京中山生物技术有限公司);② 超敏即用型S-P通用型免疫组 织化学试剂盒(福州迈新公司);③ DAB显色试盒及多聚赖氨 酸(北京中山生物技术有限公司)。 1.2.2 主要仪器 ① YWY781B医用微波仪为浙江临安 器材厂生产;② 电热恒温干燥箱为湖北省黄石市医疗器械厂 生产;③ 低温冰箱为广州容声冰箱厂生产;④ 显微镜成像系 统为日本奥林巴斯公司产品。
1.3 实验方法
免疫组织化学染色S-P法检测TGF-β1,具体步骤如下: ① 组织切片5μm,常规脱蜡至水,蒸馏水洗;② 3%过氧 化氢,37℃孵育10 min以抑制内源性过氧化物酶活性,PBS洗 4×5min;③ TGF-β1采用微波抗原修复(3档,10 min), PBS 洗4×5min;④ 正常羊血清37℃孵育10 min以减少非特异性 反应;⑤ 一抗(TGF-β1,1:40 )37℃孵育1 h,PBS洗4×5min; ⑥ 生物素标记的二抗,37℃孵育10 min,PBS洗4×5min;⑦ 链霉菌抗生物素蛋白-过氧化物酶复合物37℃孵育10 min, PBS洗4×5min;⑧ DAB显色液显色,自来水冲洗终止反应; ⑨ 苏木精复染,脱水,透明,封片。 用PBS代替一抗作为阴性对照组。
1.4 免疫组织化学结果判断
TGF-β1以胞浆出现棕黄色颗粒为阳性反应。阴性对照 组除细胞核染成蓝色外,胞浆内无棕黄色反应物。 采用HPIAS-2000高清晰度彩色病理图文报告管理系统 (同济千屏影像公司)对TGF-β1表达进行定量分析,每张切片 随机选取5个完整而不重叠的高倍镜视野(×400),测定每个 视野下阳性反应的阳性反应面积和所有细胞总面积,计算阳 性面积率。以每例5个视野的阳性面积率的平均值作为该例 的测量值。 阳性面积率=单位面积中阳性反应的总面积/单位面积 中细胞的总面积×100%。
1.5 统计学处理
对各组免疫组织化学反应阳性颗粒的阳性面积率作单因 素方差分析和SNK- q 检验,检验水准 α 为0.05。
2 结果
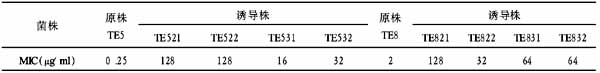
川芎嗪组肝细胞胞浆呈浅黄色或蓝色,胞浆内也无 棕黄色颗粒沉积,TGF-β1呈弱阳性或阴性表达;肝纤维化模 型组胞浆内可见较多棕黄色颗粒,TGF-β1呈强阳性表达。图 像分析结果显示:正常对照组TGF-β1表达的阳性面积率为1. 326;川芎嗪治疗组TGF-β1表达的阳性面积率为1.338;肝纤 维化模型组TGF-β1表达的阳性面积率为4.028。经单因素方 差分析,组间有显著性差异( P<0.01)。经q 检验,正常对照 组与肝纤维化模型组之间、川芎嗪治疗组与肝纤维化模型组 之间,TGF-β1的阳性面积率有显著性差异( P <0.01);正常对 照组与川芎嗪治疗组之间TGF-β1阳性面积率的差异无显著 性( P >0.05)。见表1。 表1 各组肝组织中TGF-β1表达的比较注:* 正常对照组与肝纤维化模型组比较, P <0.01;# 肝 纤维化模型组与川芎嗪治疗组比较, P<0.01;## 川芎嗪治疗 组与正常对照组比较,P >0.05。
3 讨论
肝纤维化是消化系统的一种常见病、多发病,也是肝硬化 的前期病理阶段,是由于各种慢性肝损伤引起的肝脏细胞外 基质( extra cellular matrix, ECM) 合成增加和(或)降解减少 的结果,是慢性肝病重要的病理特征,也是进一步向肝硬化发 展的必经之路。其发病机制复杂,治疗效果不十分令人满意, 甚至部分肝纤维化可发生癌变,严重影响和威胁人民身体健 康。积极探索肝纤维化发病机制,寻求有效治疗措施对降低 肝硬化发病率和死亡率具有重要意义。实验研究表明,在肝 纤维化阶段进行干预,病变是可以逆转的。 有研究报导,川芎嗪具有较强的抗纤维化作用,认为许多 细胞的增殖与细胞内的Ca 2+ 和钙调素(CaM )有关 [1~3] ,已经 发现钙通道和CaM阻滞剂可显著地抑制培养的人胚肺成纤维 细胞的增殖。研究证实,川芎嗪可降低博菜霉素所致鼠肺纤 维化组织钙含量及钙调素活性,防治鼠肺纤维化。 TGF-B是它是一种强有力的致纤维化因子 [4~6] 。肝纤维 化的主要原因在于肝损伤期间细胞外基质(extracellularm ix- true, ECM)沉积与降解的动态平衡被打破,而ECM的合成和 降解过程很大程度上由TGF-B控制。本研究结果表明: 正常 对照组肝组织间质内胶原纤维结构中,TGF-β1呈弱阳性或阴 性表达;川芎嗪治疗组肝组织间质内胶原纤维结构中,TGF-β1 呈弱阳性或阴性表达;肝纤维化模型组肝组织间质内胶原纤 维结构中,TGF-β1呈强阳性表达。经单因素方差分析,组间 有显著性差异( P<0.01)。经q 检验,正常对照组与肝纤维化 模型组之间、川芎嗪治疗组与肝纤维化模型组之间,TGF-β1 的阳性面积率有显著性差异( P <0.01),正常对照组与川芎嗪 治疗组之间TGF-β1阳性面积率的差异无显著性( P >0.05)。 肝纤维化模型组肝细胞胞浆内有密集分布的棕黄色颗粒, TGF-β1呈强阳性表达,提示TGF-B能促进胶原纤维的合成。 TGF-B主要通过促进ECM的合成与沉积及其抑制ECM的降 解来参与肝纤维化的发生。本实验结果尚显示,川芎嗪治疗 组肝细胞胞浆内无棕黄色颗粒分布,TGF-β1呈弱阳性或阴性 表达,提示川芎嗪能抑制胶原纤维的合成,保护肝细胞,从而 减轻和抑制了肝纤维化。
参 考 文 献
1 A.B. Sutton . The response of endothelial cells to TGF-β1 is depend- ent upon cell shape ,proliferative state and the nature of the substralum. J. Cell Science,1991,99(3):777~787.
2 Yoshinari Myoken. Bifunctional effects of transforming growth factor-β (TGF-β) on endothelial cell growth correlate with phenotypes of TGF-β binding sites. Exp. Cell Res. 1990,19(1):299~304.
3 Luis F. Fajardo, Transforming growth factor-β1 induces angiogenesis in vivo with a threshold pattern. Lab Invest .1996,74(3):600~608.
4 Fausto N. Multifunctional roles for transforming growth factor-B1. Lab Invest,1991,65:497.
5 L aurance D A. TGF-B: an overview. Kidney Int, 1995,47: 519.
6 A rmendariz, Borunda J,Seyer J M,et al.Regulation of TGF beta gene expression in rat liver intoxicated with carbon tetrarch- loride. FA SEB J ,1990,4:215.