注射用重组双功能水蛭素产品质量研究
【关键词】 注射用重组双功能水蛭素;质量研究
【Abstract】 The expression plasmid,HD-pPIC9K,was contructed by inserting cDNA of RGD-hirudfin (RGD-Hirudin) in yeast expression vector pPIC9K. This clone was fermented for 3 days,and the purified RGD-Hirudin was gained after purification. Quality analyses were tested. The RGD-Hirudin was measured up to standard of injection.
天然水蛭素是凝血酶的特异抑制剂,从医用水蛭的唾液腺中提取而得,可与凝血酶形成摩尔比为1:1的非共价相结合的可逆复合物,对凝血酶有很高的亲和力,使凝血酶失去裂解纤维蛋白原的能力,抑制纤维蛋白的形成,因此,低浓度的水蛭素可有效地抑制血液凝固[1]。
我们在保留天然水蛭素原有的生物学作用的基础上,将 RGD 编码顺序融合在天然水蛭素 cDNA 基因中[2~5]。构建了含RGD编码顺序的水蛭素cDNA克隆HD-pPIC9K,表达质粒转化毕赤酵母后,经筛选获得高表达菌株,并建立工程菌株,实现了高效、分泌型表达 (另文发表)。
本文重点报道重组双功能水蛭素原液的质量研究。
1 材料与方法
1.1 抗凝比活性测定
1.1.1 试剂的配制 0.5%纤维蛋白原:纤维蛋白原(上海莱士血制品有限公司)0.5g,以100ml生理盐水溶解。凝血酶:生物制品检定所制备的凝血酶,依照标示量,用生理盐水复溶后成100NIU/ml。阴性对照:以生理盐水为样品,凝血酶加入后立即凝固。标准对照:德国 Hochest 公司生产的 Refludan,按照其标示活性溶解分装成 1600ATU/支 (即0.1mg/支),冻干,具体操作步骤按说明书进行。
1.1.2 方法 凝血酶滴定法[1](所有过程在37℃水浴中操作)。
1.1.3 抗凝活性 抗凝活性 (ATU/ml)=(n-1)×100×稀释倍数,n为添加凝血酶的次数,1为扣除本底1次(即最后一次加入凝血酶,纤维蛋白原凝固),100为凝血酶活性单位100 NIU/ml,稀释倍数为所测定样品的稀释倍数。
1.1.4 蛋白含量测定 按改良Lowry法进行[6]。
1.1.5 抗凝比活性 抗凝比活性 (ATU/mg)=单位抗凝活性 (ATU/ml) / 单位蛋白含量 (mg/ml)。
1.2 抗血小板聚集比活性测定[7]
1.2.1 试剂的配制 ADP:Sigma公司,用生理盐水溶解并稀释,配成400μmol/L贮存液,-20℃保存。
1.2.2 血小板来源 正常志愿者。
1.2.3 仪器 血小板聚集仪(上海斯隆医电设备有限公司)。
1.2.4 方法 按说明书操作。
1.2.5 结果判定 血小板聚集抑制率:以未用药测得的血小板聚集率作为空白对照,体外给药后,测得的血小板聚集率除以空白对照所得的比值为相对聚集率,此相对聚集率与1的差值即血小板聚集抑制率。
血小板聚集抑制率=1-(用药后测得的血小板聚集率/空白对照)
1.3 纯度测定 高效液相色谱法(HPLC)[6]。色谱主机:SHIMAZU, LC-10AD;色谱柱:DELTA PAK C18-300A,3.9mm×15cm;流动相:A:水+0.1%TFA;流动相:B:90%乙腈+0.1%TFA;梯度:100min内,流动相B从0%到100%;流速:0.2ml/min;样品浓度:1mg/ml;上样量:20μl;检测波长:280nm。
1.4 肽图分析 TPCK处理的胰蛋白酶酶解RGD-Hirudin样品和理化对照品,分别以C8柱反相层析柱,0.1% TFA-H2O/0.1% TFA-乙腈为流动相,214nm波长检测,并用质谱测定各肽段分子量,计算总分子量[6]。
1.5 紫外光谱扫描 在200~400nm波长范围内扫描RGD-Hirudin样品和理化对照品[6]。
1.6 残留工程菌蛋白含量测定
1.6.1 Pichia 酵母全菌蛋白制备 Pichia 酵母在YPD培养基中30℃培养,菌体超声波/机械破碎,得蛋白初提物水溶液,Lowry法定量。
1.6.2 抗Pichia酵母全菌蛋白多克隆抗体制备 免疫动物:新西兰大白兔 (2.5kg,雄性);免疫蛋白:上述Pichia 酵母全菌蛋白(20mg/只),体积比1:1与完全福氏佐剂混合。免疫方法:背部皮下多点注射(1ml/点),每周1次。多抗滴度:免疫4周后,取血,分离血清,双扩散法测定其效价,若高于1:16,即颈动脉放血,分离血清(抗酵母全菌蛋白多抗);若低于1:16,则继续按上述方法免疫动物,直至效价高于1:16为止。
1.6.3 残留工程菌蛋白含量测定(ELISA) Pichia酵母全菌蛋白系列浓度:100ng/ml、80ng/ml、60ng/ml、40ng/ml、20ng/ml、10ng/ml、5ng/ml、0ng/ml。样品:1mg/ml。一抗:即自制抗Pichia 酵母全菌蛋白多克隆抗体,稀释度为1:100。二抗:华美试剂公司,羊抗兔IgG-HRP,稀释度为1:1000。显色方法:邻苯二胺/H2O2/pH5柠檬酸缓冲液。比色方法:测定波长:492nm,参比波长:655nm。
2 结果
2.1 抗凝比活性 见表1。
表1 原液抗凝血酶活性测定 (ATU/ml)

样品蛋白含量经改良Lowry法测定,为24.40mg/ml;样品抗凝比活性10,300ATU/mg,>10,000ATU/mg。
2.2 抗血小板聚集比活性 蛋白含量测定结果见表2,图1。
表2 原液抗血小板聚集活性测定结果


图1 血小板聚集抑制率曲线
0.1mg/ml原液 (体外给药) 对血小板聚集抑制率≥10%,随着剂量的加大,可以看到显著的量效关系。
2.3 纯度测定结果(HPLC) 见图2。样品的HPLC纯度为96.64%,>95%,符合静脉注射的国家标准。

图2 高效液相色谱图
2.4 肽图分析结果 见图3。图3中显示:四个峰,即组分842.5100、1119.5825、2187.8209、2818.0970为RGD-Hirudin经TPCK处理的胰蛋白酶消化后,所得的4个片段,与理论一致。它们的分子量总和与RGD-Hirudin的分子量一致。

图3 质量肽图图谱
2.5 紫外光谱扫描 见图4。样品的特征吸收波长在271.2nm。
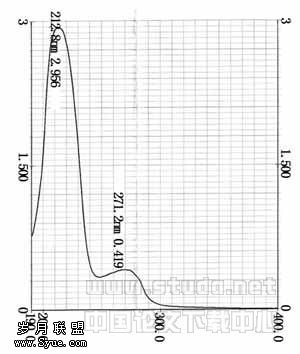
图4 紫外吸收光谱图
2.6 宿主菌蛋白残留量测定结果(ELISA) 宿主菌蛋白残留量为0.0022%。
3 讨论
药品的质量控制是一项非常重要的工作,特别对于新药,质量控制尤为重要。对于不同用药途径的药品,质量要求也不一样,静脉注射用药的质量要求最高。检定的项目有纯度分析,比活性分析等12项原液质量检定,本文了涉及静脉注射用药最为关键的质量指标的研究。
我们教研室已经完成了重组双功能水蛭素的中试研究和临床前研究,产品的质量控制是其中最重要的研究内容,经过以上所有项目测定,重组双功能水蛭素符合国家静脉注射用药的质量标准,获得了国家一类生物技术新药临床试用批件。
测定Hirudin抑制凝血酶活性的方法主要是凝血酶滴定法,其精密度为100ATU。RGD-Hirudin的抗凝比活性≥10000 ATU/mg。
我们研制的RGD-Hirudin是一种双功能的水蛭素,具有抗凝和抗血小板聚集双重功能,因此,我们建立了测定双重活性的规程,我们采用凝血酶滴定法测定其抗凝活性。根据报道,阻断血小板膜糖蛋白GPⅡb/Ⅲa复合物的抗血小板药的最简便的测定其抗血小板聚集的方法为比浊法。由于这类药对于抑制二磷酸腺苷(ADP)诱导的血小板聚集效果最好,因此,本法采用比浊法测定ADP诱导的血小板聚集,观察不同给药剂量下的血小板聚集率的变化,以反应RGD-Hirudin的抗血小板聚集比活性。由于血小板聚集试验受外界各种因素的影响,变异较大,本法采用半定量的方法测定其抗血小板活性[7]。
注射用重组双功能水蛭素的最终成品是一个混合物,组分中含分子量为7030Da 的RGD-Hirudin(30±10)%和分子量为7180Da的RGD-Hirudin (70±10)%,两者总和>95%[2]。
质量肽图和紫外吸收光谱的测定是进一步对注射用重组双功能水蛭素结构的确证,证明RGD-Hirudin是蛋白质/多肽类药物。外源性残留物含量的测定包括工程菌菌体残留蛋白和残留DNA的测定,其中残留蛋白含量采用ELISA定量;残留DNA含量采用Southern Blotting斑点杂交的方法定量 (另文发表)[8]。
【文献】
1 Markwardt F, Sturzebecker J,Griessbach U.Hirudin as an inhibitor of thrombin.Method in Enzymology,1970,19:924-932.
2 张艳玲.毕赤酵母羧肽酶对重组双功能水蛭素C端的降解作用.中华中西医杂志,2005, 6(18):2441-2443.
3 Modi NB, Baughman SA, Paasch BD, et al.Pharmacokinetics and pharmacodynamics of TP-9201, a GP ⅡbⅢa antagonist, in rats and dogs.J Cardiovasc Pharmacol,1995,25:888-897.
4 Chang JY.The functional domain of hirudin, a thrombin-specific inhibitor. FEBS Lett,1983,164:307-313.
5 Smith JW,Tachias K, Madison EL.Protein loop grafting to construct a variant of tissue-type plasminogen activator that binds platelet integrin aⅡbB3. J Bio Chem, 1995,270:30486-30490.
6 药典委员会.中华人民共和国药典(三部).北京:化学出版社,2005,附录16-17.
7 Modi NB, Baughman SA, PaaschBD,et al. Pharmacokinetics and pharmacodynamics of TP-9201, a GPⅡbⅢa antagonist, in rats and dogs. J Cardiovasc Pharmacol,1995, 25:888-897.
8 蔡旭.地高辛标记探针检测重组双功能水蛭素中残留DNA的含量.药物生物技术,2004,11(6): 392-394.











